Tabla Periódica
La Tabla Periódica es la Clasificación más reciente y Universalmente utilizada de los Elementos Químicos. Consta de una agrupación de estas sustancias puras, ordenadas de acuerdo con el tamaño de sus átomos y sus propiedades.
En su presentación final, se aprecian los conjuntos verticales de elementos con propiedades similares. A estos conjuntos o columnas se les llama Grupos, y describen Familias de elementos que son física y químicamente muy parecidos entre sí.
A los Renglones que se aprecian en la estructura de la Tabla Periódica, se les llama Periodos, y están determinados en esa forma debido a que describen la configuración electrónica de los elementos, es decir, cómo se van acomodando los electrones en sus orbitales.
Contenido del artículo
- • Historia de la Tabla Periódica
- • Triadas de Döbereiner
- • Octavas de Newlands
- • Sistema Periódico de Mendeleiev
- • Clasificación de los Elementos Químicos
- • Distribución de los Elementos Químicos
- • Grupo IA: Metales Alcalinos
- • Grupo IIA: Metales Alcalino-Térreos
- • Grupo IIIB
- • Tierras Raras
- • Grupo IVB
- • Grupo VB
- • Grupo VIB
- • Grupo VIIB
- • Grupo VIIIB
- • Grupo IXB
- • Grupo XB
- • Grupo IB
- • Grupo IIB
- • Grupo IIIA: Metales Térreos
- • Grupo IVA: Familia del Carbono
- • Grupo VA: Familia del Nitrógeno
- • Grupo VIA: Familia del Oxigeno
- • Grupo VIIA: Halógenos
- • Grupo VIIIA: Gases Nobles
Historia de la Tabla Periódica
Poco después de sentada por Dalton la Teoría Atómica, los científicos desarrollaron la idea de que los átomos de un elemento pudieran tener ciertas propiedades en parte análogas a las de otro distinto, y se hicieron muchas tentativas para clasificar los elementos.
Se había intentado clasificar los elementos con base en la Valencia, pero ésta no puede servir de base conveniente, pues hay elementos que sólo tienen una valencia, mientras que otros poseen dos o más.
Triadas de Döbereiner
Döbereiner, en 1829, señaló por primera vez la existencia de una relación significativa entre las propiedades de los elementos y sus pesos atómicos. Sus estudios le hicieron observar que hay varios grupos de tres elementos (Triadas) en los que el Peso Atómico del elemento central se aproximaba al promedio de los pesos respectivos de los elementos extremos, y que los tres elementos tienen propiedades análogas. Estas relaciones hicieron pensar a muchos químicos en la posibilidad de establecer un sistema completo en el que cada elemento ocupase su lugar correspondiente.
Octavas de Newlands
Después de las Triadas de Döbereiner, las Octavas de Newlands fueron la siguiente aportación de importancia, por parte del Químico inglés John Newlands, quien en 1863 descubrió una sorprendente regularidad al colocar los elementos hasta entonces conocidos según el orden creciente de sus respectivos números atómicos.
La lista ordenada era la siguiente: Litio (Li), Berilio (Be), Boro (B), Carbono (C), Nitrógeno (N), Oxigeno (O), Flúor (F), Sodio (Na), Magnesio (Mg), Aluminio (Al), Silicio (Si), Fósforo (P), Azufre (S), Cloro (Cl), Potasio (K).
Cada octavo elemento subsiguiente a cualquier elemento tiene propiedades análogas a éste. Por ejemplo, el Sodio (Na) y el Potasio (K) tienen propiedades parecidas a las del Litio (Li).
Newlands afirmaba que el octavo elemento, a contar de uno dado, es una especie de repetición del primero, tal como ocurre con la nota octava en la escala musical. Por tanto, Newlands dio a esta relación el nombre de “Ley de las Octavas”. Sin embargo, su sistema no dio resultado al intentar aplicarlo a los elementos que siguen al Potasio (K).
Sistema Periódico de Mendeleiev
En 1869, el químico Ruso Dmitri Ivanovich Mendeleiev dio a conocer una ordenación más completa de los elementos. Su nombre ha seguido asociado a la clasificación, aunque por separado el químico alemán Lothar Meyer llegó casi simultáneamente a una conclusión análoga.
La Tabla de Mendeleiev, completada y puesta al día, cuenta con 118 elementos químicos, de los cuales los últimos son Radiactivos, creados en Laboratorio y tienen una vida muy breve de hasta fracciones de segundo.
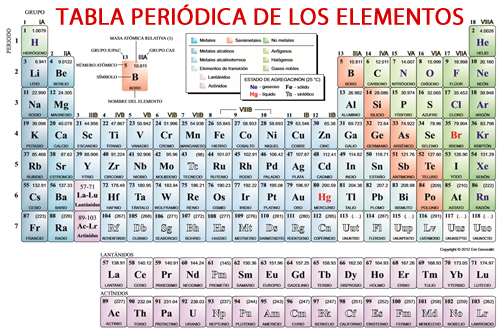
Clic en la imagen para alargar.
Clasificación de los Elementos Químicos
Los Elementos Químicos se encuentran distribuidos en la Tabla Periódica por conjuntos verticales llamados Grupos, conformados por elementos de una misma naturaleza. Los grupos son:
Grupo IA: Metales Alcalinos
Grupo IIA: Metales Alcalino-Térreos
Grupo IIIA: Metales Térreos
Grupo IVA: Familia del Carbono
Grupo VA: Familia del Nitrógeno
Grupo VIA: Familia del Oxigeno
Grupo VIIA: Halógenos
Grupo VIIIA: Gases Nobles
Grupos B: Metales de Transición
Tierras Raras: Lantánidos y Actínidos
Distribución de los Elementos Químicos
Los Elementos Químicos se presentan en la Tabla Periódica en un orden que describe cómo va creciendo su Número Atómico. Su acomodo, además, describe qué Elementos tienen similitudes en sus naturalezas químicas.
A continuación se mencionan por Grupos los Elementos Químicos. Hay que hacer la observación de que los Grupos B se sitúan en medio de los Grupos A. El siguiente listado es la distribución en el estricto orden en que se presenta la Tabla Periódica.
Grupo IA: Metales Alcalinos
Hidrógeno (H), Litio (Li), Sodio (Na), Potasio (K), Rubidio (Rb), Cesio (Cs), Francio (Fr)
El Sodio es un Elemento Quimico de Número Atómico 11, y cuya Masa Atómica es de 23 g/mol. Se caracteriza por su capacidad para formar Hidróxido de Sodio cuando se le disuelve en Agua.
El Potasio es un Elemento Quimico de Número Atómico 19 y cuya Masa Atómica es de 39.098 g/mol. Su Hidróxido, KOH, se utiliza ampliamente en procesos de Saponificación para convertir las grasas en jabones.
Tanto el Sodio como el Potasio están muy difundidos en la Naturaleza. Abundan mucho las rocas constituidas por silicatos complejos, como los feldespatos, albita NaAlSi3O8 y Ortosa KAlSi3O8. El Sodio y el Potasio son metales blandos, de color blanco argentino. El Potasio es químicamente más activo que el Sodio.
El Rubidio es un Elemento Químico de Número Atómico 37 y Símbolo Rb. Su Masa Atómica es de 85.468 g/mol. El Cesio es un Elemento Químico de Número Atómico 55 y Símbolo Cs. Su Masa Atómica es de 132.91 g/mol.
El Rubidio y el Cesio tienen propiedades químicas muy parecidas a las del potasio y las sales potásicas. Por su gran actividad química, ambos metales se emplean para eliminar los últimos vestigios de gases en los tubos de vacío.
El Francio es un Elemento Químico de Número Atómico calculado en 223 g/mol. Es el último elemento del grupo IA, y es Radiactivo, por lo que su existencia como átomo completo se limita a un tiempo muy breve.
Grupo IIA: Metales Alcalino-Térreos
Berilio (Be), Magnesio (Mg), Calcio (Ca), Estroncio (Sr), Bario (Ba), Radio (Ra)
Grupo IIIB
Escandio (Sc), Itrio (Y) y Tierras Raras
El primer grupo de los Metales de Transición comprende los elementos Escandio (Sc), Itrio (Y), Lantano (La) y Actinio (Ac). Siguiendo a los Metales Alcalino-Térreos (grupo IIA) en cuanto a su configuración atómica, estos elementos son ligeramente básicos.
El Escandio es un Elemento Químico de Número Atómico 21 y Masa Atómica de 44.96 g/mol. El Itrio es un Elemento Químico de Número Atómico 39 y con Masa Atómica 88.91 g/mol.
Salvo el Actinio, radiactivo y sin compuestos conocidos, los demás forman compuestos actuando como trivalentes. Los compuestos del Escandio se parecen a los de Aluminio; sin embargo, el Óxido (Sc2O3) es bastante enérgico como base para absorber dióxido de carbono y formar el carbonato [Sc2(CO3)3]. El itrio y el Lantano forman también Carbonatos.
Tierras Raras
Las Tierras Raras, que son elementos ubicados en el grupo IIIB dada su configuración electrónica, están conformadas en Lantánidos y Actínidos.
Lantánidos: Lantano (La), Cerio (Ce), Praseodimio (Pr), Neodimio (Nd), Prometio (Pm), Samario (Sm), Europio (Eu), Gadolinio (Gd), Terbio (Tb), Disprosio (Dy), Holmio (Ho), Erbio (Er), Tulio (Tm), Iterbio (Yb), Lutecio (Lu).
Actinidos: Actinio (Ac), Torio (Th), Protactinio (Pa), Uranio (U), Neptunio (Np), Plutonio (Pu), Americio (Am), Curio (Cm), Berkelio (Bk), Californio (Cf), Einstenio (Es), Fermio (Fm), Mendelevio (Md), Nobelio (No), Lawrencio (Lr).
Grupo IVB
Titanio (Ti), Zirconio (Zr), Hafnio (Hf), Rutherfordio (Rf)
El Zirconio es un Elemento Químico de Número Atómico 40 y cuya Masa Atómica es 91.224 g/mol. Klaproth lo descubrió como óxido en el mineral circón ZrSiO4, y como Dióxido, Badeleyita ZrO2, llamado también Zirconia, y empleada como material refractario.
El Hafnio es un Elemento Químico de Número Atómico 72 y cuya Masa Atómica es 178.49 g/mol. Como tiene características químicas similares a las del Zirconio, la separación de ambos metales en un mineral resulta difícil.
El Rutherfordio es un Elemento Químico de Número Atómico 104, y cuya Masa Atómica es aproximadamente 267 g/mol. Nombrado en honor de Ernst Rutherford, es un elemento Radiactivo que dura 13 horas como átomo completo, antes de desintegrarse.
Grupo VB
Vanadio (V), Niobio (Nb), Tantalio (Ta), Dubnio (Db)
El Dubnio es un Elemento Químico de Número Atómico 105, y cuya Masa Atómica es aproximadamente 268 g/mol. Es creado en Laboratorio, y su desintegración llega a la mitad en 28 horas.
Grupo VIB
Cromo (Cr), Molibdeno (Mo), Wolframio (W), Seaborgio (Sg)
El Molibdeno es un Elemento Químico de Número Atómico 42, y cuya Masa Atómica es de 95.95 g/mol. Se usa para fabricar aceros especiales denominados “Aceros rápidos”. El Molibdato Amónico (NH4)2MoO4 tiene aplicación en el Laboratorio como reactivo para reconocer y determinar el Ácido Fosfórico, con el que forma un compuesto complejo de color amarillo canario, FosfoMolibdato Amónico (NH4)3PO4*12MoO3, que precipita con facilidad.
El Seaborgio es un Elemento Químico de Número Atómico 106 y cuya Masa Atómica está calculada en aproximadamente 269 g/mol. Es Sintético y Radiactivo, por lo que la mitad de su masa se desintegra en 2.4 minutos.
Grupo VIIB
Manganeso (Mn), Tecnecio (Tc), Renio (Re), Bohrio (Bh)
El Tecnecio es un Elemento Químico de Número Atómico 43 y cuya Masa Atómica es 98 g/mol y es extraído de los Minerales de Uranio. No está presente en la Naturaleza en abundancia.
El Renio es un Elemento Químico de Número Atómico 75 y cuya Masa Atómica es 186.21 g/mol. La similitud de sus propiedades con las del Manganeso es muy marcada. No es tan abundante en la corteza terrestre, y es extraído de minerales que contienen Molibdeno.
El Bohrio es un Elemento Químico de Número Atómico 107 y cuya Masa Atómica es 270 g/mol aproximadamente. Es sintético y Radiactivo, teniendo una desintegración de la mitad de su masa en 5 milisegundos.
Grupo VIIIB
Hierro (Fe), Rutenio (Ru), Osmio (Os), Hassio (Hs)
El Rutenio es un Elemento Químico de Número Atómico 44, y cuya Masa Atómica es 101.07 g/mol.
El Osmio es un Elemento Químico de Número Atómico 76, y cuya Masa Atómica es 190.23 g/mol. Es uno de los Elementos más Densos que existen (Densidad = 22.5 g/ml), seguido entre otros por el Mercurio (Densidad = 13.6 g/ml).
El Rutenio y el Osmio, metales, se asemejan al hierro en algunos aspectos; como él son grises. Lo mismo que el Hierro, el Rutenio y el Osmio son muy infusibles, y se combinan fácilmente con el Oxígeno. Los Tetróxidos (RuO4), (OsO4) son sólidos, con puntos de fusión y de ebullición bajos, y sus vapores son muy irritantes, en especial los del OsO4, cuyo olor recuerda algo el del cloro, y es muy venenoso. Aunque no tiene propiedades ácidas, se le llama Ácido Ósmico. Se usa en histología para teñir tejidos.
El Hassio es un Elemento Químico de Número Atómico 108, y cuya Masa Atómica es 277 g/mol aproximadamente. Es un elemento sintético, creado en laboratorio. Es además Radiactivo, desintegrándose la mitad de su masa en 9.7 segundos.
Grupo IXB
Cobalto (Co), Rodio (Rh), Iridio (Ir), Meitnerio (Mt)
El Rodio es un Elemento Químico de Número Atómico 45 y cuya Masa Atómica es 102.91 g/mol.
El Iridio es un Elemento Químico de Número Atómico 77 y cuya Masa Atómica es 192.22 g/mol.
El Rodio y el Iridio son metales muy duros, y no se atacan por el agua regia. El Iridio se alea con Platino para aumentar su dureza. El Comité internacional de Pesas y Medidas escogió para conservar los patrones tipo de longitud y peso una aleación de 90% Platino y 10% Iridio.
También se usa una aleación de iridio para las puntas de las plumillas de oro de las plumas estilofrágicas.
El Meitnerio es un Elemento Químico de Número Atómico 109 y cuya Masa Atómica es 278 g/mol. Es Sintético y Radiactivo; su isótopo más estable es el de Masa Atómica 250 g/mol, ocurriendo la desintegración de la mitad de su masa en 10 años.
Grupo XB
Niquel (Ni), Paladio (Pd), Platino (Pt), Darmstadio (Ds)
El Paladio es un Elemento Químico de Número Atómico 46 y cuya Masa Atómica es 106.42 g/mol. Se parece a la Plata por su aspecto y por su Solubilidad en el Ácido Nítrico (HNO3). Es el único metal de este grupo acatado por este ácido. El Paladio finamente dividido tiene la propiedad de adsorber unas 800 veces su propio volumen de Hidrógeno; la cantidad depende de la temperatura y la presión.
El Platino es un Elemento Químico de Número Atómico 78 y cuya Masa Atómica es 195.08 g/mol. Es el metal más importante del grupo. Es maleable y muy dúctil, y puede soldarse al Rojo. Resiste la temperatura de la llama bunsen, pero funde fácilmente en la del soplete oxhídrico. Forma fácilmente aleaciones fusibles con Plomo y Antimonio, y se combina con Carbono, Silicio y Fósforo, volviéndose muy quebradizo. En la industria química, se emplea el Platino como catalizador.
El Darmstadio es un Elemento Químico de Número Atómico 110 y cuya Masa Atómica es 281 g/mol aproximadamente. Es Sintético y Radiactivo, desintegrándose la mitad de su masa en un tiempo demasiado pequeño, del orden de microsegundos.
Grupo IB
Cobre (Cu), Plata (Ag), Oro (Au), Roentgenio (Rg)
El Roentgenio es un Elemento Químico de Número Atómico 111 y cuya Masa Atómica es 282 g/mol aproximadamente. Nombrado en honor a Wilhelm Conrad Roentgen, descubridor de los Rayos X, tiene uno de los átomos más pesados de toda la tabla periódica. Es un Elemento sintético y radiactivo, por lo que la mitad de su masa se desintegra en 15 milisegundos.
Grupo IIB
Zinc (Zn), Cadmio (Cd), Mercurio (Hg), Copernicio (Cn)
El Copernicio es un Elemento Químico de Número Atómico 112 y cuya Masa Atómica es de 285 g/mol aproximadamente. Tiene uno de los átomos más pesados de la tabla periódica, y la mitad de su masa se desintegra en 0.24 milisegundos.
Grupo IIIA: Metales Térreos
Boro (B), Aluminio (Al), Galio (Ga), Indio (In), Talio (Tl), Nihonio (Nh)
El Galio es un Elemento Químico de Número Atómico 31 y cuya Masa Atómica es 69.723 g/mol.
El Indio es un Elemento Químico de Número Atómico 49 y cuya Masa Atómica es 114.82 g/mol.
El Talio es un Elemento Quimico de Número Atómico 81 y cuya Masa Atómica es de 204.38 g/mol. Es el último de los Elementos Térreos.
El Nihonio es un Elemento Químico de Número Atómico 113 y cuya Masa Atómica es de 286 g/mol aproximadamente.
Grupo IVA: Familia del Carbono
Carbono (C), Silicio (Si), Germanio (Ge), Estaño (Sn), Plomo (Pb), Flerovio (Fl)
El Flerovio es un Elemento Químico de Número Atómico 114 y con Masa Atómica calculada en 289 g/mol. Nombrado en honor a Gueorgui Fliórov un elemento generado en Laboratorio, radiactivo, con uno de los átomos más grandes de toda la Tabla Periódica. La mitad de su masa se desintegra en 66 segundos, por lo que es uno de los átomos que más dura estando completo. Se ha observado que su comportamiento es similar al de los Gases Nobles.
Grupo VA: Familia del Nitrógeno
Nitrógeno (N), Fósforo (P), Arsénico (As), Antimonio (Sb), Bismuto (Bi), Moscovio (Mc)
El Moscovio es un Elemento Químico de Número Atómico 115 y de Masa Atómica calculada en 290 g/mol. Nombrado con base en la provincia rusa de Moscú, es uno de los elementos superpesados, siguiendo al Flerovio, y colocado antes del Livermorio. El Moscovio es un elemento sintético, es decir, creado en Laboratorio. Tiene una inestabilidad tan marcada que su vida media es de sólo milésimas de segundo.
Grupo VIA: Familia del Oxigeno
Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te), Polonio (Po), Livermorio (Lv)
El Polonio es un Elemento Químico de Número Atómico 84 y cuya Masa Atómica es de aproximadamente 209 g/mol. Este elemento es un eslabón de la desintegración radiactiva del Uranio 238. Fue descubierto por los esposos Curie, antes que el Radio, y fue uno de los elementos principales en que se descubrió el fenómeno de la Radiactividad.
El Livermorio es un Elemento Químico de Número Atómico 116, y cuya Masa Atómica es de 293 g/mol aproximadamente. Es uno de los elementos superpesados, creado en el Laboratorio Nacional Lawrence Livermore, en honor al cual se le puso tal nombre.
Grupo VIIA: Halógenos
Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I), Astato (At), Tennessine (Ts)
El Astato es un Elemento Químico de Número Atómico 85 y cuya Masa Atómica es de aproximadamente 210 g/mol. Sigue perteneciendo a la familia de los Halógenos, siendo radiactivo. Como el Polonio, es el resultado de la desintegración radiactiva del Uranio 238, y también del Torio.
El Tennessine o Teneso es un Elemento Químico de Número Atómico 117 y cuya Masa Atómica es de 294 g/mol aproximadamente. Es el Segundo Elemento más pesado de toda la Tabla Periódica y es Radiactivo. Su isótopo más ligero, el Ts-293 tiene una vida media de 14 milisegundos. El Ts-294 tiene la mitad de su masa desintegrada a los 78 milisegundos.
Grupo VIIIA: Gases Nobles
Helio (He), Neón (Ne), Argón (Ar), Kriptón (Kr), Xenón (Xe), Radón (Rn), Oganesson (Og)
El Oganesson u Oganesón es un Elemento Químico de Número Atómico 118 y Masa Atómica calculada en un aproximado de 294 g/mol. Es el último elemento de la Tabla Periódica, colocado debajo de los Gases Nobles, y tiene el átomo más pesado. Es Radiactivo y se le han detectado cuatro isótopos.
¿Cómo citar? Graell, E. & Del Moral, M. (s.f.). Tabla Periódica.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/588-tabla_periodica.html

Últimos 10 comentarios