Tipos De Enlaces Químicos
Cuando dos o más átomos forman una molécula, se juntan por medio de una unión entre los electrones de sus últimas capas, las más superficiales. A esta unión se le llama enlace químico. Para que se forme un enlace químico, los átomos deben tener su octeto incompleto, es decir, menos de ocho electrones en su última capa, que es el número que les dará estabilidad química.
Contenido del artículo
Hay tres tipos de enlaces químicos:
- Enlaces iónicos
- Enlaces covalentes
- Enlaces metálicos
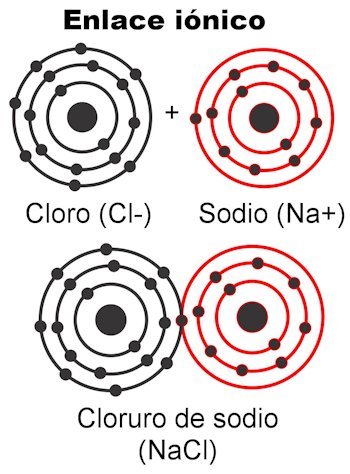
Enlaces iónicos
Los enlaces iónicos son aquellos en los que los electrones de valencia se atraen por fuerzas electrostáticas. El (o los) átomo(s) que tenga(n) de 1 a 4 electrones de valencia podrá entregarlos para formar el enlace; esto le otorga una carga positiva, porque se estaría deshaciendo de las cargas negativas. Por otro lado, el (o los) átomo(s) que tenga(n) de 5 a 7 electrones de valencia podrán recibir los necesarios para llegar a 8.
Esto les da carga negativa, porque captan electrones, que son negativos. El hecho de que se puedan captar o entregar electrones le da a los átomos la carga eléctrica. De acuerdo con la ley de Coulomb, las cargas formadas en ambos átomos van a atraerse con una fuerza, que es la electrostática antes mencionada. Las cargas negativas atraen a las positivas y viceversa. Cargas opuestas se atraen. Una vez que esta fuerza los une, se forma la molécula.
Los enlaces iónicos se presentan sobre todo entre átomos de metales y no metales. Los metales ceden sus electrones y siempre llevan carga positiva, participando como catión (+). Los no metales son receptores de electrones y llevan por lo general carga negativa, participan como aniones (–) pero también sucede que lleven carga positiva, esto cuando forman grupos de átomos cargados llamados radicales, como el amonio NH4+, el carbonato CO3-2, el fosfato PO4-3.
Entre los compuestos químicos que se forman por enlaces iónicos se encuentran:
Cuando estas sustancias se encuentran disueltas en agua se disocian, es decir, se separan en sus cargas eléctricas y estas quedan dispersas en el agua junto a los iones hidrógeno H+ e hidroxilo (OH-) que forman al agua. La mezcla que se forma es una disolución llamada electrolito.
- Continúa leyendo: Enlace iónico
Enlaces covalentes
Los enlaces covalentes son aquellos en los que se comparten electrones sin desprenderlos del átomo, es decir, sin que se formen cargas eléctricas. Los átomos quedan unidos por proximidad y se valen de la fuerza con la que el núcleo atrae a los electrones. Una vez formado el enlace, los dos o más núcleos de los átomos terminan atrayendo a los electrones compartidos, con lo que se logra cumplir la regla del octeto y se logra que la molécula sea estable.
Hay varias formas de enlace covalente, y son:
- Enlace covalente
- Enlace covalente coordinado
- Enlace covalente polar
- Enlace covalente no polar
El enlace covalente es tal cual el que se describió al inicio. Los átomos participantes comparten electrones para entre todos tener su octeto completo. No hay cargas eléctricas aquí, porque no se desprenden electrones, solo se comparten.
En el enlace covalente coordinado es solo un átomo el que aporta todos los electrones necesarios para el enlace. El otro átomo simplemente se une y toma como propios estos electrones. La molécula se forma así. Es el caso, por ejemplo, del ácido sulfúrico H2SO4 en el que el azufre comparte dos pares de electrones con átomos de oxígeno.
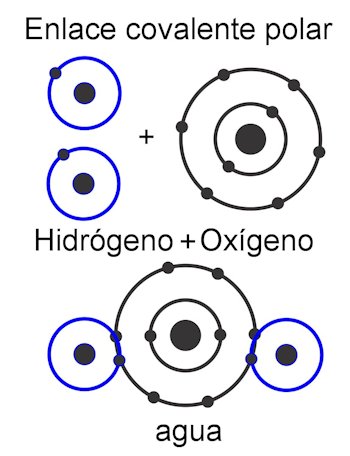
En el enlace covalente polar, las fuerzas entre los átomos quedan inclinadas hacia un lado de la molécula. Esto cuando hay distintos tipos de átomos en la molécula. Esta fuerza se mide en las unidades Debye, y mientras mayor sea su valor de un lado de la molécula, esta será más polar. Esto significa que se forman polos en la estructura, y por eso se les da este nombre. Sus fuerzas son asimétricas.
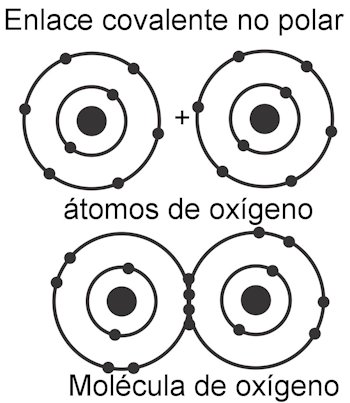
En el enlace covalente no polar, las fuerzas entre los átomos son uniformes a lo largo de toda la molécula, y por eso no se forman polos en su estructura. Funciona como una sola unidad y por eso es muy difícil, casi imposible, que se divida en sus cargas. Esto hace que sea insoluble en agua. Es el caso de compuestos como los alcanos, que tienen sus fuerzas parejas por toda la molécula. Sus fuerzas son simétricas.
- Continúa leyendo: Enlace covalente
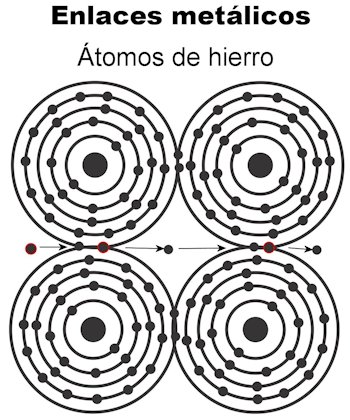
Enlace metálico
Los átomos de un metal se mantienen unidos por medio de enlaces metálicos. En este tipo de enlace, los electrones de todos los átomos se atraen formando una red cristalina que se queda firme. Las uniones de la red cristalina tienen a todos los electrones intercalados y dispuestos para transportar la corriente eléctrica y el calor cuando se les transmita. En los metales de transición esta estructura de enlaces metálicos es más notable, porque sus átomos son más grandes.
Ejemplos de enlace iónico
Algunas sustancias que presentan enlaces iónicos son:
- Cloruro de sodio NaCl. Sus iones son Na+ y Cl-.
- Cloruro de potasio KCl. Sus iones son K+ y Cl-.
- Cloruro de calcio CaCl2. Sus iones son Ca+2 y Cl-.
- Cloruro de magnesio MgCl2. Sus iones son Mg+2 y Cl-.
- Cloruro de estroncio SrCl2. Sus iones son Sr+2 y Cl-.
- Cloruro de bario BaCl2. Sus iones son Ba+2 y Cl-.
- Cloruro de aluminio AlCl3. Sus iones son Al+3 y Cl-.
- Sulfato de sodio Na2SO4. Sus iones son Na+ y SO4-2.
- Sulfato de potasio K2SO4. Sus iones son K+ y SO4-2.
- Sulfato de calcio CaSO4. Sus iones son Ca+2 y SO4-2.
- Sulfato de calcio MgSO4. Sus iones son Mg+2 y SO4-2.
- Sulfato de estroncio SrSO4. Sus iones son Sr+2 y SO4-2.
- Sulfato de bario BaSO4. Sus iones son Ba+2 y SO4-2.
- Fosfato de sodio Na3PO4. Sus iones son Na+ y PO4-3.
- Fosfato de potasio K3PO4. Sus iones son K+ y PO4-3.
- Fosfato de magnesio Mg3(PO4)2. Sus iones son Mg+2 y PO4-3.
- Fosfato de calcio Ca3(PO4)2. Sus iones son Ca+2 y PO4-3.
- Fosfato de aluminio AlPO4. Sus iones son Al+3 y PO4-3.
- Fosfato ferroso Fe3(PO4)2. Sus iones son Fe+2 y PO4-3.
- Fosfato férrico FePO4. Sus iones son Fe+3 y PO4-3.
Ejemplos de enlace covalente
Algunas sustancias que presentan enlaces covalentes son:
- Metano CH4.
- Etano C2H6.
- Propano C3H8.
- Butano C4H10.
- Pentano C5H12.
- Hexano C6H14.
- Heptano C7H16.
- Octano C8H18.
- Propileno CH2=CH2–CH3.
- Acetileno C2H2.
- Alcohol metílico CH3
- Alcohol etílico C2H5
- Alcohol propílico C3H7
- Alcohol isopropílico CH3CH(OH)CH3.
- 2-propanona o acetona CH3COCH3.
- Formaldehído HCHO.
- Acetaldehído CH3
- Propionaldehído CH3CH2
- Butiraldehído CH3CH2CH2
- Ácido fórmico HCOOH.
Ejemplos de enlace metálico
Algunas sustancias que presentan enlace metálico son:
- Zinc Zn
- Cadmio Cd
- Cobre Cu
- Plata Ag
- Oro Au
- Níquel Ni
- Paladio Pd
- Platino Pt
- Cobalto Co
- Rodio Rh
- Iridio Ir
- Hierro Fe
- Rutenio Ru
- Osmio Os
- Manganeso Mn
- Cromo Cr
- Molibdeno Mo
- Wolframio W
- Vanadio V
- Circonio Zr
Sigue con:
¿Cómo citar? Figueroa, D. & Del Moral, M. (s.f.). Tipos De Enlaces Químicos.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4045-tipos_de_enlaces_quimicos.html

Últimos 10 comentarios