Titanio
El Titanio es un elemento químico, integrante de la gran serie de los metales de Transición, agrupado con el Circonio y el Hafnio. Su número atómico es 22, y su Símbolo es Ti. Los tres elementos de este grupo se caracterizan por Puntos de Fusión y de Ebullición altos. Además, se emplean en la fabricación de aceros.
Contenido del artículo
Historia del Titanio
En 1791, Gregor descubrió este metal, mientras investigaba una arena especial de Cornualles. Tres años más tarde, Klaproth halló el mismo elemento en el mineral Rutilo, y lo llamó Titanio, del latín Titanes, hijos de la Tierra. En 1910, Hunter preparó titanio puro calentando Tetracloruro de Titanio y Sodio.
Estado Natural del Titanio
El Titanio se encuentra en la mayoría de minerales, reemplazando al Silicio en muchos Silicatos; pero se le parece tanto que su presencia suele pasar inadvertida. El mineral más común de este elemento es la ilmenita, FeTiO3.
El Dióxido de Titanio TiO2, se encuentra en varias modificaciones, como Rutilo, Anatasa y Brookita.

El Metal libre puede obtenerse reduciendo el Dióxido con Aluminio, o por la acción del Sodio sobre el Tetracloruro.
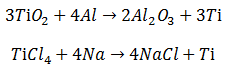
Propiedades Físicas y Químicas del Titanio
Peso atómico de 47.87 g/mol. Su Densidad es de 4.507 gramos cada mililitro. Su Punto de Fusión es a los 1668°C, y su Punto de Ebullición es a 3287°C.
Es capaz de conducir la electricidad en menor medida que otros metales, presentando una Conductividad Eléctrica de 2.38 millones de Siemens cada metro.
Puede conducir el calor de manera regular, manifestando una Conductividad Térmica de 21.9 Watts cada Kelvin-metro.

Usos de Compuestos de Titanio
El Ferrotitanio, una aleación producida reduciendo ilmenita con carbón en un horno eléctrico, se emplea para fabricar aceros especiales. El Titanio elimina el Nitrógeno (formando Nitruros) y otras impurezas del acero, al que comunica por ello gran resistencia y tenacidad, haciéndole capaz de soportar tensiones y choques súbitos.
El Dióxido de Titanio, TiO2, puede prepararse a partir de la ilmenita por la acción combinada del Cloruro de Hidrógeno (HCl) y del Cloro (Cl2) a una temperatura bastante elevada para volatilizar el cloruro férrico formado.
El Dióxido de Titanio es un importante pigmento blanco en pintura. También se usa para dar opacidad al papel, para producir un esmalte amarillo sobre la porcelana, y para teñir dientes artificiales.
Además, el Dióxido de Titanio es un componente indispensable para los bloqueadores solares que se aplican sobre la piel humana. Es capaz de reflejar eficientemente la radiación Ultravioleta, aportando así seguridad al usuario de que la piel no recibirá el impacto directo de los rayos solares, sino que serán convenientemente desviados. Se previenen así casos de cáncer de piel y quemaduras que pueden ascender hasta segundo grado.

El Tetracloruro de Titanio, TiCl4, hierve a 136.4°C. Se obtiene en estado líquido haciendo pasar Cloro Cl2 sobre una mezcla calentada de carbón y Dióxido de Titanio. El líquido se hidroliza con facilidad al esparcirlo en el aire produciendo humos densos blancos del Dióxido y de Ácido Clorhidrico. Se emplea para producir cortinas de humo.
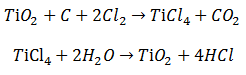
Ejemplos de Compuestos y Minerales del Titanio
Dióxido de Titanio TiO2
Rutilo TiO2
Anatasa TiO2
Brookita TiO2
Tetracloruro de Titanio TiCl4
Ferrotitanio
Ilmenita FeTiO3
Carburo de Titanio TiC
Hidruro de Titanio TiH2
Nitruro de Titanio TiN
Titanato de Bario BaTiO3
Titanato de Estroncio SrTiO3
Titanato de Magnesio MgTiO3
Sulfuro de Titanio TiS2
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Titanio.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4789-titanio.html
