Ejemplo de Cristalización
La Cristalización es el proceso en que se forman partículas sólidas a partir de una fase homogénea. Esta formación de partículas puede suscitarse a partir de un vapor, o mediante la solidificación de una sustancia fundida, como ocurre en la formación de grandes monocristales, o bien como cristalización de una disolución líquida.
La manera más común es la Cristalización de una Disolución Líquida. Es industrialmente importante, dada la gran variedad de materiales que se comercializan en forma cristalina. Su amplia utilización se debe a las razones siguientes: Un cristal formado a partir de una disolución impura es esencialmente puro (a excepción de cuando se formen cristales mixtos), y la Cristalización proporciona un método práctico para la obtención de sustancias químicas puras en una condición adecuada para su envasado y almacenamiento.
Es indispensable definir el concepto de Magma: En la Cristalización industrial de una disolución, la mezcla bifásica formada por las aguas madres y los cristales de todos los tamaños, contenida en un cristalizador y que se saca como producto, recibe el nombre de Magma.
Contenido del artículo
Tamaño de los Cristales
Un buen rendimiento y una elevada pureza son los dos objetivos principales de la Cristalización, pero el aspecto y el intervalo de tamaños del producto cristalino es también importante. Si los cristales intervienen en un proceso posterior, para filtración, lavado, reacción con otros productos químicos, transporte y almacenamiento, por ejemplo, es deseable que su tamaño sea el adecuado y sea uniforme. Si los cristales se comercializan como un producto acabado, la aceptación por el consumidor exige cristales individuales que exhiban buena resistencia, un tamaño uniforme, que no formen agregados y que no se vayan aglomerando en el envase. Por estos requisitos es indispensable controlar la Distribución del Tamaño de los Cristales. Este es uno de los principales objetivos en el diseño y operación de cristalizadores.
Geometría de los Cristales
Un Cristal es el tipo de materia no viva más altamente organizada. Se caracteriza por el hecho de que sus partículas constituyentes, que pueden ser átomos, moléculas o iones, están dispuestos en formaciones ordenadas tridimensionalmente, de nombre redes espaciales.
Como consecuencia de esta disposición de las partículas, cuando los cristales se pueden formar sin la interferencia de otros cristales o cuerpos extraños, se presentan como poliedros con vértices agudos y caras planas. Aunque los tamaños relativos de las caras y la distancia entre vértices de distintos cristales del mismo material pueden ser muy diferentes, los ángulos formados por caras correspondientes de todos los cristales del mismo material son iguales y característicos del material.
Sistemas cristalográficos

Cristales de Sal Epsom
Dado que todos los cristales de una determinada sustancia tienen los mismos ángulos interfaciales, con independencia de que existan grandes diferencias en lo que respecta al desarrollo de las caras individuales, se pueden clasificar las formas de los cristales con base en estos ángulos.
Las siete clases o sistemas son: Cúbico, Hexagonal, Trigonal, Tetragonal, Ortorrómbico, Monoclínico y Triclínico. Un determinado material puede cristalizar en dos o más sistemas diferentes, dependiendo de las condiciones de la Cristalización. Por ejemplo, el Carbonato de Calcio se presenta más frecuentemente en la naturaleza en la forma Hexagonal (Calcita), pero también existe en la forma Ortorrómbica (Aragonito).
A un Cristal que mantiene una Semejanza Geométrica durante el Crecimiento, en condiciones ideales, se le llama Cristal Invariante.
Fundamentos de la Cristalización
La Cristalización puede estudiarse desde los puntos de vista de Pureza, Rendimiento, Requerimientos de Energía y Velocidades de Nucleación y Crecimiento.
Pureza de los Cristales
Un cristal perfectamente formado es totalmente puro, pero cuando se retira del magma final, retiene aguas madres por quedar ocluidas en el interior de la masa de sólidos. Cuando las aguas madres retenidas, que contienen impurezas, se secan sobre el producto, se genera contaminación, cuyo alcance depende de la cantidad y grado de impureza de las aguas madres retenidas por los cristales.
Equilibrio
El equilibrio en los procesos de cristalización se alcanza cuando la disolución está saturada y la relación de equilibrio para los cristales grandes es la curva de solubilidad. Nota: La solubilidad de los cristales más pequeños es mucho mayor que la de los cristales de tamaño ordinario. La solubilidad aumenta más o menos rápidamente con la Temperatura. Hay sustancias que presentan la condición opuesta, que a temperatura menor corresponde un aumento en solubilidad.
Muchas sustancias inorgánicas importantes cristalizan con agua de cristalización. En algunos casos se forman diferentes hidratos, dependiendo de la concentración y la temperatura, y los equilibrios de fases en tales sistemas pueden ser muy complicados.
Los diagramas de fases para el sistema Sulfato de Magnesio – Agua se representan en la siguiente imagen:
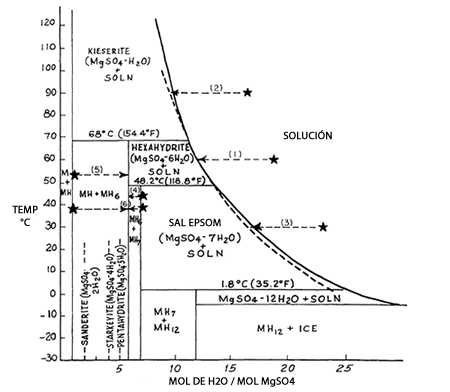
En el Diagrama del Sistema Sulfato de Magnesio - Agua, el eje de las abscisas (horizontal) muestra la cantidad molar de Agua con respecto a la de MgSO4, y el de las ordenadas la temperatura en grados Celsius. Se aprecian las regiones en que las moléculas de Agua se involucran más en la cristalización; esto junto a la curva de solubilidad. Más allá, donde se encuentra la palabra "SOLUCIÓN", sólo se manifestará la sal disuelta en el agua, sin formación de cristales. La presencia de Sal Epsom, por ejemplo, que contiene siete moléculas de agua acopladas a la de Sulfato de Magnesio, se destaca entre las temperaturas 1.8°C y 48.2°C.
Rendimientos
En muchos procesos industriales de Cristalización, los cristales y Aguas Madres están en contacto suficiente tiempo para alcanzar el equilibrio y las aguas madres están saturadas a la temperatura final del proceso. El rendimiento del proceso se puede calcular entonces a partir de la concentración de la disolución original y la solubilidad para la temperatura final. Si durante el proceso se produce una evaporación apreciable, ésta debe de ser conocida o estimada.
Cuando la velocidad de crecimiento de los cristales es lenta se requiere un tiempo considerable para alcanzar el equilibrio. Esto se cumple especialmente cuando la disolución es viscosa o cuando los cristales se acumulan en el fondo del cristalizador, de forma que hay poca superficie de cristales expuesta a la disolución sobresaturada. En tales situaciones las aguas madres finales pueden retener una apreciable sobresaturación y el rendimiento real será menor que el calculado a partir de la curva de solubilidad.
Si los cristales son anhidros, los cálculos del rendimiento son sencillos, ya que la fase sólida no tiene disolvente. Cuando la cosecha contiene agua de cristalización es preciso tener en cuenta el agua que acompaña a los cristales, ya que esta agua no está disponible para el soluto que queda en disolución. Los datos de solubilidad se dan generalmente bien en partes de masa de material anhidro por cien partes de masa de disolvente total o en tanto por ciento en masa de soluto anhidro. Estos datos ignoran el agua de Cristalización.
La clave para los cálculos de Rendimiento de solutos hidratados es expresar todas las masas y concentraciones en función de la sal hidratada y libre de agua. Puesto que esta última cantidad es la que permanece en la fase líquida durante la cristalización, las concentraciones y cantidades basadas en el agua libre puede restarse para obtener el resultado correcto.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Cristalización.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4528-ejemplo_de_cristalizacion.html
