Ejemplo de Densidad
La Densidad es la Propiedad intensiva de la materia que indica cuánta Masa hay de una sustancia en cada unidad de Volumen. Se dice que es una propiedad intensiva, porque no depende de la masa total de la sustancia presente, sino que basta con tomar una pequeña muestra para conocerla.
Contenido del artículo
Unidades de Medida de la Densidad
La Densidad, por su concepto, se medirá en las siguientes unidades:

Medición de la Densidad
La Densidad de la materia es una propiedad que se puede medir en cualquier ámbito, desde doméstico hasta laboratorio. Cuando se hace la medición en casa, se puede recurrir a un recipiente que tenga un volumen conocido, como un vaso o una jarra, y se puede llenar con la sustancia, sea sólida o liquida.
Sabiendo previamente la masa del recipiente vacío, teniendo una báscula a la mano, se mide la masa del recipiente lleno. Por resta de masas, se conocerá la masa de la sustancia contenida.
La densidad se calculará entonces dividiendo la masa de la sustancia entre el volumen abarcado en el recipiente.
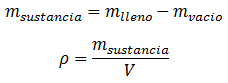
Cuando la densidad se mide en un laboratorio, y la sustancia de trabajo es gaseosa, se recurrirá a un recipiente rígido, esférico generalmente, y de volumen conocido e invariable. Ya conociendo la masa de gas inyectado al recipiente, asegurándose de que no haya fugas de esta masa, se calculará la división de esta masa entre el volumen del recipiente. Se sabe que un gas abarca todo el volumen del contenedor que lo recibe.
Cuando la densidad se mide en un laboratorio, y la sustancia de trabajo es líquida, se contará con un recipiente llamado Picnómetro, que es un pequeño contenedor de vidrio, calibrado, medido y certificado por la empresa proveedora. El volumen del picnómetro es más preciso que el de cualquier otro contenedor. De hecho, el nombre “Picnómetro” se deriva de las raíces griegas que significan “Medidor de Densidad”. Para comenzar con la medición, se llena primero el picnómetro con el líquido, asegurándose de que esté completamente lleno y bien sellado, para que se esté trabajando con el volumen exacto. Ya conociendo la masa del picnómetro vacío para descartarla, se dividirá la masa de la sustancia liquida entre el volumen estandarizado del picnómetro.

Cuando la densidad se mide en laboratorio y la sustancia es sólida, se recurre a medidores de volúmenes básicos, como las probetas. Se llena la probeta de la sustancia sólida, y se hace el mismo procedimiento para pesarlo, tomando en cuenta que la masa de la probeta debe descartarse para conocer la del sólido.
En el caso de los sólidos, al ser un material granulado, habrá burbujas de aire que abarquen los espacios vacíos, así que la densidad será menos precisa mientras más espaciadas estén las partículas del sólido. Esta circunstancia nos lleva a dos variantes de la Densidad: La Densidad Aparente y la Densidad Real.
Densidad Aparente y Densidad Real
La Densidad Aparente es aquella que se mide cuando el sólido está recién vaciado en la probeta, aún con todo ese aire implicado en su vaciado. Hay veces que la Densidad Aparente aún se divide en Densidad Aparente Floja, que es, propiamente dicho, medida con el material recién vaciado, y Densidad Aparente Compacta, que se mide después de aplicar un golpeteo a la probeta llena para acomodar mejor el sólido contenido.
La Densidad Real se refiere a aquella que se mide ya con instrumentación más especializada que las probetas, utilizando por ejemplo balanzas analíticas que den mediciones con hasta cuatro números decimales.
Ejemplos de Cálculo de Densidad
Se supondrá que se han medido doce masas y volúmenes diferentes, así que se harán cuatro casos para cada unidad de medida.
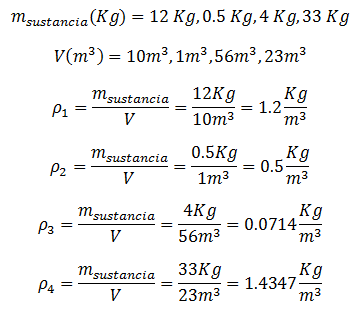
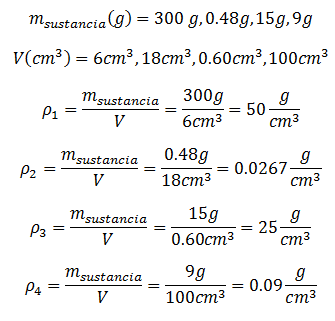

Ejemplos de Elementos Químicos con Mayor Densidad
Los Elementos Químicos en su estado natural llegan a tener diferentes densidades, dependiendo del tamaño de sus átomos y cómo éstos se ligan para formarlos. A continuación se citan varios ejemplos de los elementos más densos y los menos densos.
De todos los elementos cuyas densidades se conocen, los Más Densos son:
Osmio, con 22.6 g/cm3
Iridio con 22.4 g/cm3
Platino con 21.45 g/cm3
Renio con 21.04 g/cm3
Neptunio con 20.2 g/cm3
Plutonio con 19.84 g/cm3
Wolframio con 19.35 g/cm3
Oro con 19.32 g/cm3
Uranio con 18.95 g/cm3
Tantalio con 16.65 g/cm3
Protactinio con 15.4 g/cm3
Californio con 15.1 g/cm3
Berkelio con 14.78 g/cm3
Americio con 13.67 g/cm3
Mercurio con 13.55 g/cm3
Ejemplos de Elementos Químicos con menor Densidad
Los menos densos son los siguientes:
Hidrógeno con 0.09 g/cm3
Helio con 0.18 g/cm3
Litio con 0.53 g/cm3
Potasio con 0.86 g/cm3
Neón con 0.9 g/cm3
Sodio con 0.97 g/cm3
Nitrógeno con 1.25 g/cm3
Oxigeno con 1.43 g/cm3
Calcio con 1.55 g/cm3
Rubidio con 1.63 g/cm3
Fluor con 1.7 g/cm3
Magnesio con 1.74 g/cm3
Argón con 1.78 g/cm3
Fósforo con 1.82 g/cm3
Berilio con 1.85 g/cm3
Así que cada cm3, o mililitro de volumen de cada elemento tendrá ese peso en gramos. Como se podrá notar a través de una breve consulta, el orden de los menos densos casi obedece a la sucesión de números atómicos de los elementos en la Tabla Periódica.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Densidad.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/37-fisica/4682-ejemplo_de_densidad.html
