Estructura Del Carbono
El comportamiento del carbono en millones de compuestos corresponde a cuatro electrones desapareados, sin que ninguno de ellos tenga preferencia o mayor capacidad de reacción que los otros tres. Hasta la fecha la única forma que se ha encontrado para explicar este comportamiento es por medio de la teoría de la hibridación. Recordemos que hibridar significa mezclar. Si se mezcla el orbital 2s con los tres orbitales 2p, se tendrá cuatro orbitales híbridos, 2sp3, que tienen exactamente la misma energía y por tanto los electrones colocados en dichos orbitales tendrán la misma capacidad de reacción, como ocurre en todos los compuestos con enlace covalente sencillo.Enlaces carbono-carbono.De esta forma existe la hibridación SF3 (que forma cuatro enlaces sencillos llamados Sigma ð), la hibridación SP2 (que forma un enlace doble llamado y otros dos enlaces sencillos) y la hibridación SP (que forma un enlace triple y un sencillo). Los enlaces sencillos son: • Muy fuertes. • Se llevan a cabo entre 2 híbridos o un híbrido y un halógeno o un hidrógeno. • No pueden rotar. Los enlaces dobles son: • Fáciles de romper. • Se forman solo entre orbitales puros. • Pueden rotar fácilmente.
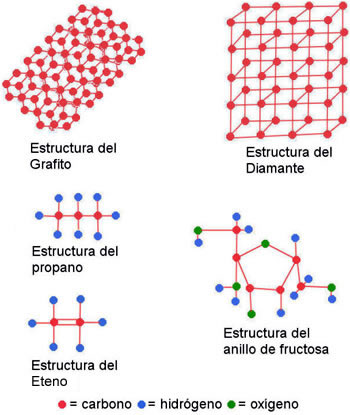
El carbono es un elemento muy importante, ya que puede crear moléculas muy complejas, con gran cantidad de átomos. Esto es debido a su estructura atómica y las propiedades químicas que esta estructura le proporciona. Los átomos del carbono ocupan los orbitales energéticos s y p. El Nivel 1s, con tiene dos átomos, y está saturado, por haber alcanzado su número máximo de átomos. En su nivel sp, (recordemos que el siguiente nivel, sp, tiene un número de saturación de 8 electrones) solamente tiene 4 electrones. Por la tendencia de los elementos químicos a formar enlaces estables, y por esta especial característica del carbono, estos átomos tienen la característica de ceder o admitir los 4 electrones, para estabilizar sus órbitas, lo que le permite actuar con las valencias +4 y -4. Los átomos de valencia, independientemente de su subnivel, tienen la misma capacidad de reacción; sin embargo, según el subnivel energético en que se realicen los enlaces, por efectos de la hibridación (combinación de los orbitales s con los orbitales p, que nos dan cuatro orbitales 2sp [2sp, 2sp1, 2sp2, 2sp3] cada uno disponible para ceder o recibir un electrón) pueden crear diferentes enlaces estructurales entre átomos de carbono, que puede darse en forma natural o ser creados en un laboratorio. Así tenemos que cuando los enlaces se dan en el subnivel energético 2sp3, la estructura tiende a ser prismática, tetraédrica y cristalina. En la naturaleza esta es la estructura del diamante. Cuando los enlaces se llevan a cabo en el subnivel 2sp2, forma estructuras triangulares o hexagonales, que forman capas de anillos. En la naturaleza se encuentra en la estructura del grafito. Si los enlaces suceden a nivel 2sp, entonces las estructuras son lineales y planas. En el laboratorio se ha logado controlar los subniveles de unión de las estructuras químicas para que adquieran ciertas características, como pueden es el caso de los fulerenos o los nanotubos, en los cuales el control de las “conexiones” estructurales del carbono, permiten dar ciertas características geométricas y cristalinas a cada unión atómica para adquirir las estructuras deseadas. En la química orgánica, las combinaciones del carbono pueden adquir diversas estructuras: Lineal (como el propano), Arbóreas (como 2-metil-4etil-pentano) y de anillo (como el benceno) y también se pueden combinar, como la combinación del la estructura de anillo con ramificaciones (arbórea) como el caso de la fructosa.
¿Cómo citar? Graell, E. & Del Moral, M. (s.f.). Estructura Del Carbono.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/607-estructura_del_carbono.html

Últimos 10 comentarios