Ejemplos de Fenómenos Químicos
La química estudia los elementos componentes de la materia, los compuestos que forman y sus posibles combinaciones, los productos resultantes de esas combinaciones y su estructura, y los fenómenos que producen, aceleran o retardan esas modificaciones. Un fenómeno químico es aquel en el que dos o más sustancias sufren un cambio que las altera en su estructura interna, dando origen a una, dos o más sustancias, diferentes a la materia original.
A diferencia de los fenómenos físicos, en los que se alteran algunas propiedades de los objetos, pero siempre son la misma sustancia o compuesto, en los fenómenos físicos se altera la estructura de las sustancias, quedando como resultado, otras sustancias diferentes a las originales. Es decir que todos los fenómenos químicos son reacciones químicas, que dan como resultado una o más sustancias molecularmente diferentes a la sustancia o sustancias originales.
Contenido del artículo
Tipos de fenómenos químicos:
Los fenómenos químicos pueden clasificarse en relación al resultado como sigue:
Síntesis
Dos o más compuestos se unen para formar un compuesto más complejo.
Descomposición
Un compuesto complejo se descompone para formar moléculas más sencillas.
Desplazamiento
Uno de los elementos o un radical de las moléculas reaccionantes pasa a formar parte de la otra molécula con la que reacciona.
Doble desplazamiento
Las moléculas reaccionantes intercambian un elemento o un radical, dando origen a dos moléculas distintas a las que reaccionaron.
Ahora bien, en cuanto a las reacciones como fenómenos químicos, podemos mencionar los siguientes:
Oxidación
La oxidación es una reacción en la que el oxígeno se combina con otro elemento, dando un óxido, en el caso de los metales, y un oxi-ácido si se combina con elementos no metálicos. La reacción es lenta y no aumenta la temperatura del material.

Combustión
La combustión es una forma de oxidación rápida, en la que además se desprenden luz y calor, es decir, es una reacción exógena.
Alcalinización
Es cuando un metal se combina con un radical hidroxilo (radical con la forma –OH).
Acidificación
Es cuando se combina un elemento no metálico con el hidrógeno
Neutralización
Es la combinación de un hidróxido con un ácido, dando como resultado la formación de agua y una sal.
Reducción
Es la eliminación del oxígeno de un óxido, para obtener el metal puro, por la reacción con el hidrógeno de un ácido.
Ionización
Al disolver una sal en agua, los elementos que la componen se separan en átomos con cargas eléctricas, que pueden ser positiva (catión) o negativa (anión). A este tipo de soluciones se les llama electrolitos.
Electrólisis
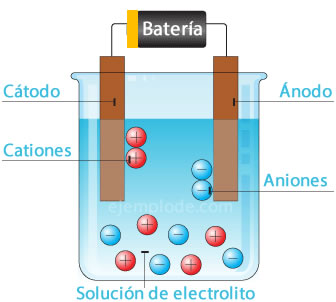
Cuando se hace pasar corriente eléctrica a través de un electrolito, la electricidad hace que se desprendan átomos del agua, dirigiéndose el ion hidrógeno, con carga positiva, al polo negativo (cátodo), y el oxígeno, con carga negativa, se dirige al polo positivo (ánodo). Cuando se aplica electrólisis en un ácido, uno de los efectos es desplazar el elemento metálico al ánodo.
Catálisis
Dos sustancias que en condiciones generales no reaccionan, o lo hacen muy lentamente, pueden reaccionar en forma muy rápida en presencia de una tercera sustancia, la cual no sufrirá cambios ni antes o ni durante la reacción. A este tipo de sustancia se les llama catalizadores.
Fermentación
Es la obtención de un cambio químico, especialmente en los compuestos orgánicos, por la acción de bacterias.
Ejemplo de fenómenos químicos:
1. Una reja sin pintar, tendrá contacto con el oxígeno del aire y con el agua, y empezará a mostrar herrumbre (oxidación)
2. El acercar un madero al fuego hará que éste se queme, haciendo que algunas de las moléculas de carbono que lo conforman se mezclen rápidamente con el oxígeno, desprendiendo dióxido de carbono, quedando como residuo la madera quemada y hollín (combustión)
3. La descomposición de los alimentos se debe a la acción digestiva de las bacterias, que alteran la estructura química de los componentes. (Fermentación).
4. La batería de un automóvil produce electricidad por la reacción entre el electrolito y las celdas metálicas con que está formada, provocando el desprendimiento de iones que producen la electricidad. Para cargarla, el flujo de corriente realiza una acción electrolítica que devuelve los iones a las placas.
5. Los gases producidos por el motor de los automóviles, es estable y difícilmente se descompone después de que ha salido del motor y alcanza la temperatura ambiente. El convertidor catalítico contiene una espuma de platino, que, al calentarse a 500°C, aproximadamente, permiten que se descompongan los gases en compuestos más sencillos, sin que el platino sufra modificaciones.
6. Al disolver sal en agua, se divide en iones de cloro y de sodio.
7. La efervescencia que se produce al mezclar jugo de limón con bicarbonato de sodio es una reacción de neutralización.
8. Cuando sangramos, la sangre adquiere un color más oscuro, debido a la oxidación del hierro que se encuentra en los glóbulos rojos. Por esto también la sangre venosa es más oscura, y la sangre arterial más brillante.
9. El cromado de partes de automóvil, usa la electrólisis para depositar el cromo en la pieza metálica que se está cromando.
10. En la digestión como fenómeno químico, la acción del ácido clorhídrico sobre los alimentos es para descomponer las moléculas complejas que los forman, en moléculas más pequeñas que pueden ser absorbidas con más facilidad en el intestino.
¿Cómo citar? & Del Moral, M. (s.f.). Ejemplos de Fenómenos Químicos.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4428-ejemplo_de_fenomenos_quimicos.html
