Ejemplos de Análisis Volumetrico
En Química Analítica, la Volumetría es un Método de Análisis que consiste en la medida del Volumen de Reactivo necesario para Reaccionar Estequiométricamente con el Analito, que es la sustancia a determinar.
Reaccionar Estequiométricamente se refiere a que las sustancias interactúen químicamente, de acuerdo con la proporción que marca la ecuación química ya balanceada.
La sustancia que se va a investigar se llama Analito. De esta sustancia se tomará como muestra un volumen conocido y medido exactamente, al que llamaremos Alícuota, contenido en un matraz Erlenmeyer para comenzar con el análisis.
Contenido del artículo
Conceptos del Análisis Volumétrico
El Análisis Volumétrico, al ser un tipo de Análisis Químico, lleva implicada una reacción química. Se llevará a cabo esta reacción química entre la muestra con cantidad desconocida de sustancia investigada, y una cantidad conocida de otra sustancia, capaz de reaccionar con la primera.
Las sustancias de la reacción estarán en solución acuosa, y se medirán los volúmenes de soluciones que interactuaron para llegar al fin de la reacción, que será visible gracias a un indicador que dará coloración dentro del matraz.
En el Análisis Volumétrico, a la solución acuosa de Concentración Conocida se le llama Solución Patrón, Estándar o Titulante, y servirá de referencia para, terminando la reacción, hacer el cálculo que revelará la cantidad de la sustancia investigada.
Este procedimiento de ir haciendo reaccionar ambas soluciones es llamado Titulación Química o Valoración, que es la parte fundamental del Análisis Volumétrico. Consiste en ir vertiendo paulatinamente la Solución Patrón (Titulante) en la Alícuota (Muestra), hasta que el indicador muestre el cambio con una diferencia de color.
Un Indicador es una sustancia química que se añade a la Alícuota, mostrando una coloración, y que cuando la reacción acabe, éste va a cambiar de color.
Un Análisis Volumétrico consta de una serie sencilla de pasos:
1.- Preparación de Solución Patrón
2.- Preparación de la Muestra o Alícuota
3.- Titulación Química
4.- Medición de Volúmenes
5.- Cálculo de Sustancia investigada.
Al punto en que ya han reaccionado completamente las dos sustancias, se le llama Punto de Equivalencia.
Como en cualquier método químico de Análisis, en el Análisis Volumétrico hay requisitos para que haya buenos resultados:
-La reacción química debe ser Selectiva, es decir, la solución patrón reaccionar únicamente con la muestra.
-La reacción química debe ser Estequiométrica, o sea, obedecer las proporciones marcadas en la ecuación química balanceada.
-La reacción química debe ser Cuantitativa; se refiere a completarse en un 99.9% en el punto de equivalencia.
-Debe haber un punto final detectable en la reacción, lo que se confirmará mejor con el indicador.
Patrón Primario
Los Patrones Primarios son sustancias de elevada pureza cuya concentración en solución se calcula directamente de la cantidad pesada y el volumen utilizado de agua.
Así, se podrán hacer reaccionar con soluciones de trabajo, para conocer las concentraciones de las últimas y convertirlas en soluciones estándar.
Ejemplos de Patrones Primarios son:
-Carbonato de Sodio (Na2CO3): Se utiliza para estandarizar ácidos, como el Ácido Sulfúrico.
-Biftalato de Potasio: Es el patrón primario para preparar soluciones estándar de Bases, como el Hidróxido de Sodio.
-Cloruro de Sodio (NaCl): Se utiliza para estandarizar soluciones de Nitrato de Plata.
-Carbonato de Calcio (CaCO3): Patrón primario para EDTA (Acido EtilenDiaminoTetracético).
Un Patrón Primario debe de cumplir con varias características indispensables:
Debe tener una Pureza Elevada, Estabilidad Atmosférica, Ausencia de agua de Hidratación, Bajo costo y Fácil de conseguir, y Peso equivalente alto.
Clasificación de los Análisis Volumétricos
Dependiendo de las especies químicas con las que se trabaje para hacer un análisis, será el tipo de la Volumetría:
Volumetría Acido-Base: Se trabaja, ya sea con un ácido o con una base, para analizar muestras que lleven ácidos o con bases.
Volumetría de Precipitación: Se llama también Argentometria, y utiliza una solución estándar de Nitrato de Plata para determinar cuántos Cloruros hay en una muestra.
Volumetría de Complejación: Se utiliza una solución estándar de un agente complejante, como el EDTA, para medir la concentración de Dureza, es decir, Carbonatos de Calcio y Magnesio, en el Agua.
Volumetria REDOX: La reacción ocurre entre una sustancia oxidante y otra reductora.
Indicadores
De los numerosos indicadores utilizados en Volumetrias, destacan tres:
1.- Naranja de Metilo: Toma una coloración anaranjada en la alícuota, que será titulada con un ácido. Cuando se llegue al punto de equivalencia, el indicador se tornará amarillo.
2.- Fenolftaleina: Es transparente en el principio en la alícuota, que será titulada con una base. Cuando se llega al punto de equivalencia, el indicador se tornará rosado.
3.- Negro de Eriocromo: Es el indicador utilizado para determinar la dureza en el agua. En el principio es morado en la alícuota, hasta que se va titulando con un agente complejante. Al final de la reacción, se vuelve azul.

Instrumentos en un Análisis Volumétrico
En un Análisis Volumétrico se van a utilizar una serie de instrumentos que, si no se cuenta con ellos, no se puede desarrollar adecuadamente:
1.- Matraz Volumétrico: Es un recipiente como bulbo en su parte baja, aplanado del fondo, que tiene una columna delgada en la que se va agregando el líquido. Tiene una marca para señalar dónde debe de situarse el menisco del líquido, para que abarque el volumen exacto. Se utiliza para contener Soluciones Patrón; gracias a la exactitud de su volumen, se asegura una concentración conocida.

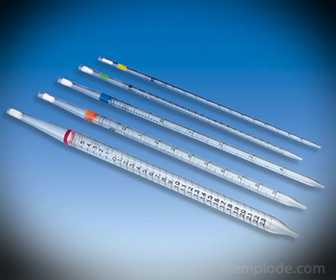
2.- Pipetas: Son tubos delgados graduados que permiten medir cantidades confiablemente exactas de líquido. Las hay hasta de 25 mililitros, y permiten una toma de muestra precisa.
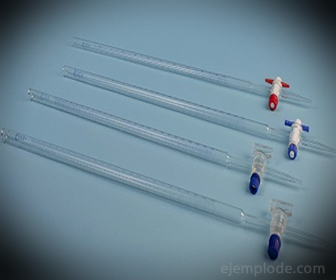
3.- Bureta: Es un tubo alargado con capacidad de 50 mililitros, que va a contener la Solución Patrón. En uno de sus extremos tiene una válvula reguladora de flujo que irá vaciando la Solución en la Alícuota.
4.- Matraces Erlenmeyer: Son recipientes de base plana, forma cónica que termina en un borde cilíndrico. Este diseño los convierte en los indicados para Titulaciones química, ya que no permiten que el agitar de las soluciones las desborde. Se requerirán mínimo tres si se quiere hacer pruebas repetitivas, para asegurar el resultado confiable.

Cálculos en un Análisis Volumétrico
Como se manejan soluciones acuosas, las magnitudes de importancia para un Análisis Volumétrico son la Concentración y el Volumen.
La ecuación principal de la Volumetria se basa en cuatro datos principales:
![]()
C1= Concentración de la Muestra (incógnita)
V1= Volumen de la Alícuota, con la que se trabajó en el análisis
C2= Concentración de Solución Patrón utilizada para llegar al punto de equivalencia
V2= Volumen Solución Patrón necesario para llegar al fin de a reacción
Se sustituyen los datos en la ecuación, quedando como incógnita únicamente la Concentración buscada. Por supuesto, todos los datos deben encontrarse en las mismas unidades.
Ejemplos de Análisis Volumétricos
Determinación de Cloruros (Cl-) por Argentometria, con Nitrato de Plata.
Determinación de Bromuros (Br-) por Argentometria, con Nitrato de Plata.
Determinación de Cianuros (CN-) por Argentometria, con Nitrato de Plata.
Determinación de Carbonato de Magnesio (MgCO3), por Complejometria, con EDTA.
Determinación de Carbonato de Calcio (CaCO3), por Complejometria, con EDTA.
Análisis de Ácido Sulfúrico (H2SO4) con Hidróxido de Sodio (NaOH).
Análisis de Hidróxido de Sodio (NaOH) con Ácido Clorhídrico (HCl).
Determinación de Antimonio (III) con Permanganato de Potasio (KMnO4).
Determinación de Arsénico (III) con Permanganato de Potasio (KMnO4).
Determinación de Titanio (III) con Permanganato de Potasio (KMnO4).
Determinación de Molibdeno (III) con Permanganato de Potasio (KMnO4).
Determinación de Hierro (II) con Permanganato de Potasio (KMnO4).
Determinación de ión Oxalato con Permanganato de Potasio (KMnO4).
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplos de Análisis Volumetrico.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4770-ejemplo_de_analisis_volumetrico.html
