Ejemplos de Combustión
La Combustión es el fenómeno en que al hacer arder materia orgánica, esta sufre una degradación acompañada de emisión de energía en forma de calor. Se trata de una de las reacciones químicas Exotérmicas más útiles y aprovechadas en la Industria y a nivel Doméstico.
Es catalogada como la reacción de oxidación más rápida, comparada con la implicada en la corrosión de los metales, en que la liberación de energía es ínfima y el proceso dura mucho tiempo.
En 1778, Lavoisier describió el fenómeno de la combustión tal como se conoce hoy en día, como consecuencia de sus experimentos sobre calcinación de Estaño y Plomo. Esto ya permitió rechazar la llamada Teoría del Flogisto, sustentada hasta entonces.
Establecida en el siglo XVII por Becker y Stahl, la Teoría del Flogisto suponía que durante una combustión se escapaba una especie de espíritu volátil, misterioso, llamado Flogisto, que constituía, más que un principio material, la cualidad de inflamabilidad de las sustancias.
El Oxígeno componía el “aire desflogisticado” por su mayor capacidad de absorber flogisto. Cuando la madera, por ejemplo, ya no podía arder, es que había perdido todo su flogisto.
La combustión necesita de varios factores para generarse y mantenerse activa. Estos son el Combustible, el Comburente y un Iniciador.
El Iniciador es un generador de chispa o fuente de calor que rompa los primeros enlaces de la materia que va a arder, para que así continúe el proceso.
Contenido del artículo
Combustible
El combustible es la sustancia que arderá para degradarse químicamente. Casi exclusivamente se trata de materia orgánica, aunque para casos muy especializados se ven involucrados el gas Hidrógeno, el metal Cobre, y el no metal Fósforo.
Mientras más compleja sea la estructura orgánica, más enlaces habrá por romper entre átomos de Carbono, y más duradera será la reacción. Pero lo más importante será la liberación de energía, mayor ante tal complejidad.
Los combustibles más frecuentemente utilizados para fines domésticos como calefacción y cocción de alimentos son el Metano, que es el Alcano más sencillo, y cuya energía es más accesible; y el Gas Licuado de Petróleo (Gas LP). El Gas LP está constituido por los gases Propano y Butano, de cadenas de tres y cuatro átomos de Carbono respectivamente. Eso les confiere más poder calorífico en comparación con el Metano que consta de un solo átomo de Carbono.
Dos manifestaciones del Carbono elemental son utilizados como combustibles para el funcionamiento de las locomotoras, como el coque y la hulla, que son variedades minerales de éste.
Los combustibles conformados por Carbono e Hidrógeno se transforman en Dióxido de Carbono y Agua, y los que contienen otros elementos que no sean Carbono e Hidrógeno dejarán además un residuo llamado Ceniza, que puede estar constituido por elementos como Calcio, Potasio, Sodio, Fósforo, Azufre. Específicamente, estará formado por los óxidos de estos elementos como resultado de la combustión.
Para que un combustible pueda encenderse adecuadamente, necesita encontrarse en estado gaseoso o como vapor. Esta condición es indispensable por el factor de área de contacto, porque si su estado es líquido, la chispa sólo será capaz de encender las partículas superficiales.
Ejemplos de Combustibles
Metano (CH4)
Propano (C3H8)
Butano (C4H10)
Gas Licuado de Petróleo (Gas LP)
Coque
Hulla
Combustóleo o Fueloil
Queroseno
Gasolina
Comburente
El comburente es la sustancia que apoya la iniciación y continuidad de la reacción química de combustión. En estrictos términos, sigue siendo un reactivo, y el combustible se mantendrá inerte sin su presencia. En la gran mayoría de los casos se trata del gas Oxígeno y se utiliza la mezcla de gases Aire para sustentar las combustiones a nivel global.
El Aire está conformado por 21 por ciento en masa de Oxígeno, que es el aprovechado para reaccionar constantemente con los combustibles hasta que estos se agoten en el cumplimiento de su propósito. El siguiente 78 por ciento lo abarca el gas Nitrógeno, que en su manifestación diatómica es inerte. De hecho, su falta de reactividad le permite amortiguar la presencia del Oxígeno. Si el Nitrógeno no existiera en nuestra atmósfera, seríamos inmediatamente consumidos en el Oxígeno presente, en una combustión iniciada por la radiación solar. El último 1 por ciento está constituido por diversos gases, como el Monóxido de Carbono, Dióxido de Carbono, Argón, Kriptón.
Combustión Completa y Combustión Incompleta
Cuando la reacción de combustión tiene lugar, es muy difícil que sólo se genere como producto el Dióxido de Carbono. Se requerirían condiciones muy controladas de presión y cantidades de reactivo. A la reacción en estas condiciones ideales se le llama Combustión Completa, y el mecanismo sería como sigue:
![]()
Sin embargo, lo que pasa en la realidad es que casi siempre hay una reacción secundaria en que se genera Monóxido de Carbono, debido a un escaso suministro de Oxígeno o una elevada presión. Ya sucediendo ambas reacciones en paralelo, el mecanismo es el que sigue:
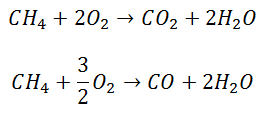
Oxígeno Teórico y Oxígeno en Exceso
De acuerdo con la ecuación química de la combustión, el combustible requerirá de una cantidad estequiométrica de comburente para consumirse por completo en una Combustión Completa, es decir, generando sólo Dióxido de Carbono y Agua. A este Oxígeno que participa en la Combustión Completa se le llama Oxígeno Teórico.
Cuando la cantidad de Oxígeno suministrado al sistema es superior al Oxígeno Teórico, se le llama Oxígeno en Exceso.
Generalmente se expresa el comburente en términos de Aire: Aire Teórico o Aire en Exceso. El Oxígeno se considera para balanceo de las ecuaciones y estimación de la cantidad necesaria.
Energía en la Combustión
Ya se sabe que la Combustión es una reacción Exotérmica y que la Energía Química liberada como Energía Térmica es aprovechada a nivel global para transformarla en Energía Mecánica y posteriormente en Energía Eléctrica, por citar el ejemplo de las Centrales Termoeléctricas.
Dependiendo de la complejidad de la cadena del compuesto orgánico que se use como combustible, será la cantidad de energía liberada. La ruptura de los Enlaces Carbono-Carbono y Carbono-Hidrógeno es la responsable de esta energía. Mientras más Carbonos e Hidrógenos tenga la molécula, mayor será el calor disponible.
Por ejemplo:
La energía de Enlace Carbono-Carbono es de: 83 Kcal/Kmol
La energía de Enlace Carbono-Hidrógeno es de 99 Kcal/Kmol
La energía de Enlace Hidrógeno-Hidrógeno es de 104 Kcal/Kmol
Combustión espontánea
Cuando una sustancia es un mal conductor del calor, éste se va acumulando en el punto de aplicación del calentamiento, hasta que llega al punto de inflamación. La oxidación es lenta al principio, pero al ocurrir la ignición, se da una aceleración en la oxidación, hasta que la sustancia se va consumiendo por completo. A este fenómeno se le llama Ignición espontánea o Combustión Espontánea.
Otras sustancias, que son buenos conductores de calor, harán que este se propague, por lo que no tenderán a encender, a menos que se encuentren finamente divididos para que la calefacción tenga más área de contacto y ocurra la reacción en cadena.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplos de Combustión.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4497-ejemplo_de_combustion.html
