Ejemplos de Ley De Dalton
El científico inglés John Dalton (1766-1844) fue un físico y químico que hizo muchas contribuciones a la compresión y clasificación de los elementos y sustancias químicas. Entre sus principales aportes está el primer modelo de representación de los átomos y los compuestos mediante una representación gráfica. También formuló la llamada “Ley de las proporciones múltiples” conocida también como Ley de Dalton.
Sobre las combinaciones químicas, Louis Proust (1754-1826) formuló la “Ley de las proporciones constantes”, en la que recoge la observación de que las sustancias químicas siempre se combinan en la misma proporción para producir los mismos compuestos. Es decir, que si se combinan hidrógeno y oxígeno, siempre se combinarán en las mismas proporciones, para producir agua. Sin embargo esta ley no explicaba cómo es que había compuestos diferentes formados por las mismas sustancias.
Con su teoría atómica, Dalton se dio cuenta de que cuando se combinan algunas sustancias simples, pueden producirse compuestos diferentes y que las cantidades de una de las sustancias varían en una proporción sencilla.
La Ley de Dalton se enuncia así: Los pesos de un elemento que se unen con una misma cantidad de otro para formar distintos compuestos químicos varían según una relación muy simple.
Esto significa que si conocemos cómo se combinan sustancias en proporciones simples, y la cantidad de una de las sustancias permanece constante y otra sustancia la ponemos en una proporción simple, como una relación de 2, 3 o 4 en relación a la proporción original, en cada caso obtendremos una sustancia diferente. Esto sucede por ejemplo, al combinar fósforo, hidrógeno y oxígeno.
Si combinamos 1 volumen de fósforo, 3 volúmenes de hidrógeno y 2 volúmenes de oxígeno, obtendremos ácido hipofosfórico:
P + 3H + 2O —> PO2H3
Si en la reacción anterior variamos solamente el oxígeno en una proporción simple de 2, obtendremos ácido fosfórico:
P + 3H + 4O —> PO4H3
Hay que tomar en cuenta que en esta época aún no se conocía el concepto de valencia atómica, por lo que no se sabía exactamente por qué algunas sustancias podían combinarse en proporciones variables y otras no.
Ejemplo de la Ley de Dalton
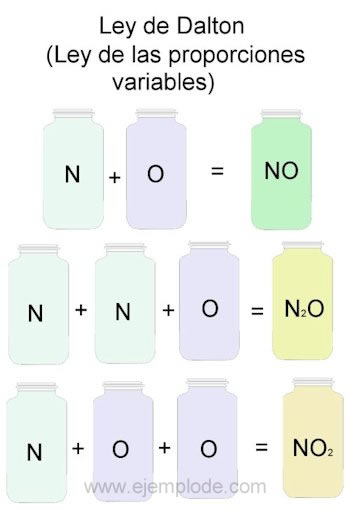
Para ejemplificar la Ley de Dalton, tomaremos como referencia las combinaciones de Nitrógeno (N) y oxígeno (O).
Cuando se combinan en la misma proporción, es decir, uno a uno, obtendremos óxido nítrico:
N + O —> NO
Si mantenemos constante el volumen de nitrógeno y variamos en 2 el oxígeno, obtendremos peróxido de nitrógeno:
N + 2O —> NO2
Si sobre la base del óxido nítrico, ahora mantenemos constante el oxígeno y variamos el volumen de nitrógeno en 2, obtendremos óxido nitroso:
2N + O —> N2O
Si el artículo te fue de utilidad, no olvides regalarnos un +1.
¿Cómo citar? Figueroa, D. & Del Moral, M. (s.f.). Ejemplos de Ley De Dalton.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4024-ejemplo_de_ley_de_dalton.html

Últimos 10 comentarios