Ejemplo de Líquidos
Se asigna el nombre de Líquido a la materia que se encuentra en ese estado físico. Se caracteriza por el constante movimiento de sus átomos o moléculas, con un deslizamiento semejante a numerosas capas que se superponen constantemente. A este peculiar “movimiento de capas” se le define con el verbo “fluir”, por lo que, para fines prácticos, los líquidos son “fluidos”.
Es posible afirmar que todos los elementos y los compuestos existentes se pueden manifestar en estado líquido, pero se depende de condiciones específicas para que sus partículas constituyentes tomen esa cinética que los caracteriza.
Hay muchas sustancias que manifiestan el estado líquido a temperatura ambiente, estandarizada a 25°C. Por ejemplo el Agua, el Mercurio, los Alcoholes, algunos Hidrocarburos, los Aceites, los Dioles, algunos Hidrácidos y Oxiácidos.
Pero, en el caso de las sales y los metales, por citar algunas especies que se encuentran en estado sólido en un prolongado rango de temperaturas, se requiere un proceso de calentamiento extremo para que se dé el fenómeno de Fusión o Fundición.
Contenido del artículo
Propiedades de los Líquidos
Los líquidos se diferencian de los gases y los sólidos por características específicas:
- Toman la forma del recipiente que los contiene, abarcando un volumen definido y limitado.
- Pueden tener su origen a partir de un gas, disminuyendo la Temperatura y/o comprimiéndolo. Y a partir de un sólido, elevado la Temperatura lo suficiente, hasta que su actividad vence las fuerzas de atracción entre las moléculas.
- Desde el punto de vista teórico, un líquido se considera como una continuación de la fase gaseosa en una región de volúmenes pequeños y atracciones moleculares muy grandes. Las fuerzas cohesivas en un líquido deben ser más fuertes que las de un gas incluso a presiones muy altas, porque son suficientemente elevadas para mantener las moléculas en un volumen definido.
- No debe pensarse que están rígidamente fijas; tienen algún grado de movimiento, pero restringido, y su camino libre medio es mucho menor que en la fase gaseosa.
- A causa de la proximidad de las moléculas entre sí, se observan efectos propios característicos, que en los gases son secundarios cuando se presentan. Así sucede con el agrupamiento, asociación y orientación general de las moléculas en algún orden.

El mercurio es el único metal
líquido a temperatura ambiente.
Fenómenos críticos
Si un líquido como el agua, se coloca en un tubo vacío, que se sella después, se evaporará en parte y ejercerá una presión análoga a la de un gas, y si la temperatura es constante se establece un equilibrio entre las fases líquidas y vapor. La presión de vapor establecida es característica de cada líquido y es constante a cualquier temperatura dada; se le conoce como la Presión Saturada de Vapor del líquido que se incrementa continuamente con la temperatura.
Así a 25°C la presión de vapor del agua es 23.76mmHg (milímetros de Mercurio), mientras que a 100°C es 760mmHg, equivalente a la Presión Atmosférica. A medida que el agua contenida en el tubo sellado se calienta de nuevo, se evapora más y más agua y la presión se sigue incrementando. En todas las ocasiones existe un límite definido de demarcación o menisco, entre el líquido y la fase de vapor.
Cuando se alcanza una temperatura de 374°C, sin embargo, el menisco se vuelve indefinido y desaparece. A esta temperatura, las propiedades del líquido y vapor se hacen idénticas, y no hay distinción entre ambos. Un líquido en esta condición se encuentra en el punto crítico. La temperatura, la presión de vapor saturado y el volumen molar correspondiente a este punto se designa como la temperatura crítica, la presión crítica y el volumen crítico respectivos. Sus valores, que son constantes y característicos de cada sustancia, se conocen como Constantes Críticas. Para el Agua, por ejemplo, son las siguientes: Tc=374.4°C, Pc=219.5 atmósferas, y Vc=58.7cm3 por mol.
Viscosidad
Los fluidos poseen una propiedad conocida como viscosidad, que se define como la resistencia que una parte de éstos ofrece al desplazamiento de la otra. La viscosidad se produce por efecto de corte de una capa de fluido al deslizarse sobre otra, y es muy distinta de la atracción intermolecular. Puede pensarse que está causada por la fricción interna de las moléculas y está presente tanto en los gases ideales como en los reales y líquidos.
Para determinar mejor la viscosidad, se supondrá que un líquido se estratifica en capas o planos moleculares. Hay que designar al área de cada plano por A, y por dy la distancia interplanar. Se supondrá además que cada uno de los planos se mueve a la derecha con las velocidades v1, v2, etc., donde cada valor de esta sucesión es mayor que el precedente según el incremento dv.
El flujo que tiene lugar así se denomina laminar, y es diferente del turbulento en el cual no se conserva el paralelismo de los planos. En el flujo laminar, la fuerza requerida para mantener una diferencia de velocidad estacionaria dv entre dos planos paralelos cualesquiera es directamente proporcional a A y dv, y es inversamente proporcional a dy. En consecuencia:
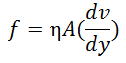
Donde η es una constante de proporcionalidad llamada Coeficiente de Viscosidad del fluido. La cantidad dv/dy en la ecuación se refiere a la velocidad de corte G, mientras que f/A, fuerza por unidad de área, se denomina Fuerza de Corte, F. En función de F y de G, la ecuación se transforma en:
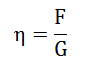
El Coeficiente de Viscosidad resulta así como la fuerza requerida para mover una capa de fluido con una diferencia de velocidad de un centímetro por segundo respecto a otra capa situada a un centímetro de separación. Aunque la fuerza f puede variar con las condiciones experimentales, el coeficiente de viscosidad es una cantidad física característica de cada fluido.
En el sistema cgs, la viscosidad se expresa en poises, siendo éste el coeficiente que requiere una fuerza de una dina cuando A, dv y dy son todas la unidad en la ecuación inicial. Esta unidad suele expresarse en poises o centipoises, es decir 10-2 poises.
Los líquidos, al exhibir una resistencia a fluir mucho mayor que los gases, tienen unos Coeficientes de Viscosidad Mayores.
15 ejemplos de Líquidos
- Agua H2O
- Aceite para cocina
- Anticongelante (mayoría Glicoles)
- Mercurio elemental (único metal líquido a temperatura ambiente)
- Miel de Abeja
- Ácido Muriático (solución acuosa de cloruro de hidrógeno)
- Ácido Sulfúrico
- Glicerina
- Petróleo crudo
- Aceite lubricante para motor de combustión interna
- Aceite para dirección hidráulica
- Agua de mar
- Alcohol etílico
- Bebidas Energéticas e Isotónicas
- La Sangre
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Líquidos.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/37-fisica/4541-ejemplo_de_liquidos.html
