Ejemplos de Ley De Boyle
Al estudiar las propiedades de los gases, Robert Boyle, por un lado, y Edme Mariotte, por otro, sin conocerse ni conocer sus experimentos, observaron que los gases pueden comprimirse, y que su volumen varía en forma proporcional a la presión a que se les somete.
Para comprender su investigación, tenemos que tener presente que hay tres características a tomar en consideración en este estudio de los gases: temperatura, volumen y presión.
Temperatura: Es la temperatura a la que se encuentra un gas en las condiciones del experimento. Puede ser expresada en grados centígrados (°C) o en grados Kelvin o de cero absoluto (°K). En el caso de la Ley de Boyle, se considera que la temperatura no varía, es decir, que permanece constante.
Volumen: Es el espacio que ocupa un gas dentro de un recipiente cerrado. En primera intensión, el volumen de un gas es el volumen del recipiente. Para su representación, se considera que el recipiente es cerrado y con un émbolo, como por ejemplo, una jeringa.
Presión: Es la presión que tiene el gas a través del émbolo. En un recipiente cerrado, sobre el que se coloca el émbolo como tapa, sin hacer presión, se considera que está a la presión atmosférica (1 at).
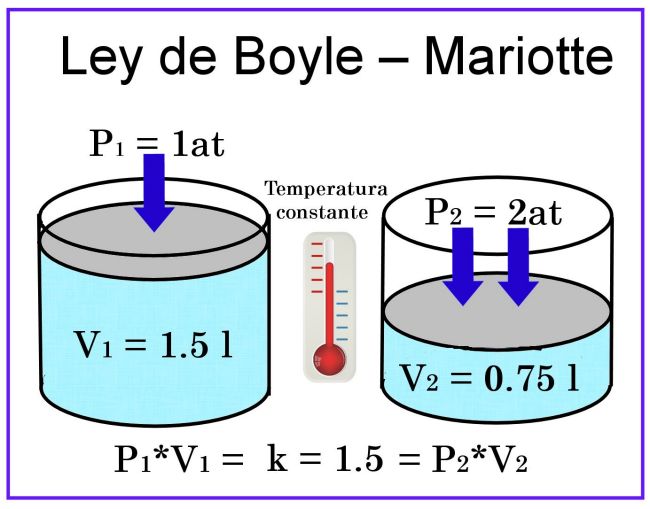
En las observaciones de Boyle y Mariotte, se considera que la temperatura es constante, por lo que no afectará la medida.
En cuanto al volumen, si consideramos por ejemplo, un recipiente cilíndrico de 1 litro de capacidad, y su tapa es un émbolo deslizante, al colocarlo tapando el recipiente lleno de aire, la presión será de 1 at, mientras que el volumen será de 1 litro. Si se ejerce sobre el émbolo una presión de 2 atmósferas, el volumen del gas se reducirá a la mitad, es decir, a 0.5 litros o 500 ml. Si la presión aumenta a 4 atmósferas, el volumen se reducirá a la cuarta parte, es decir, a 0.25 litros, o 250 ml.
Basado en estas observaciones, se enunció la llamada Ley de Boyle: A temperatura constante, el volumen de un gas es inversamente proporcional a la presión ejercida sobre el.
Esto quiere decir que cuando aumenta la presión, disminuye el volumen, y cuando la presión disminuye, el volumen aumenta.
Esto lleva a establecer que existe una relación entre la presión de un gas y su volumen, que al variar uno de los componentes, el otro varía en la misma proporción, permaneciendo la relación constante, es decir:
P*V=k
P = Presión
V = Volumen
k = constante de la relación presión-volumen
Para comprenderlo, supongamos que tenemos un recipiente de 2.5 litros, que está lleno de aire y la presión sobre la tapa-émbolo es de 1.5 at. Entonces, la constante de su relación es:
P*V=k = (2.5)(1.5) = 3.75
Si ahora aumentamos la presión a 3 atmósferas, dividimos k entre la presión P, y tendremos:
k/P = V
3.75 / 3 = 1.25 litros
Que como vemos, al aplicar el doble de la presión, el volumen es la mitad del original, y se mantiene la constante de la relación presión volumen. Esto se expresa de la siguiente manera:
V1P1 = V2P2 = k
Es decir, que el producto del volumen 1 por la presión 1, es igual al producto del volumen 2 por la presión 2, y esta relación permanece constante.
Ejemplos de la Ley de Boyle-Mariotte
Ejemplo 1. Calcular el volumen que ocupará un gas, que está ocupando un volumen de 3.75 litros, a una presión de 2 at si se le aplica una presión de 3.5 at.
V1 = 3.75 l
P1 = 2 at
V2 = ?
P2 = 3.5 at
Como V1P1 = V2P2 = k
Calculamos la constante del sistema:
V1P1= k = (3.75)(2) = 7.5
Despejamos V2:
V2 = k/P2 = 7.5/3.5 = 2.143 litros
Ejemplo 2. Calcular la presión que se aplica a un gas, si está ocupando un volumen de 2.25 litros, si a una presión de 1.75 at tiene un volumen de 3.25 litros.
V1 = 3.25 l
P1 = 1.75 at
V2 = 2.25 l
P2 = ?
Calculamos la constante del sistema:
V1P1= k = (3.25)(1.75) = 5.6875
Despejamos P2:
P2 = k/V2 = 5.6875/2.25 = 2.53 at
Ejemplo 3. Calcular la presión original de un gas, si al aplicarle una presión de 4.5 at, ocupa un volumen de 1.4 litros, y su volumen original era de 2.2 litros.
V1 = 2.2 l
P1 = ?
V2 = 1.4 l
P2 = 4.5 at
Calculamos la constante del sistema:
V2P2= k = (1.4)(4.5) = 6.3
Despejamos P2:
P1 = k/V1 = 6.3/2.2 = 2.863 at
¿Cómo citar? Figueroa,V. & Del Moral, M. (s.f.). Ejemplos de Ley De Boyle.Ejemplo de. Recuperado el 13 de Junio de 2024 de https://www.ejemplode.com/37-fisica/4217-ejemplo_de_ley_de_boyle.html
