Qué Es La Electrólisis
En Química, la Electrólisis es el fenómeno en el que una corriente eléctrica corre por una Solución Acuosa de un Compuesto iónico, y empieza a dirigir los iones (partículas cargadas) del Compuesto a dos Electrodos, positivo (Ánodo, atrae Aniones con carga negativa) y negativo (Cátodo, atrae Cationes con carga positiva). Este fenómeno se rige por la ley de la Electrostática, que indica que las cargas opuestas se atraen.
Contenido del artículo
Electrolitos
En 1883, Michael Faraday descubrió que las disoluciones acuosas de ciertas sustancias conducen la corriente eléctrica, mientras que no lo hacen las disoluciones de otras sustancias.
Para ensayar si una disolución acuosa conduce o no la corriente eléctrica, Faraday diseñó un sencillo aparato que consiste en un circuito de 110 volts de corriente continua, una lámpara, y dos electrodos de metal o grafito conectados a la fuente de corriente.
Si los electrodos se sumergen en agua, la cantidad de corriente que circula es tan pequeña que la lámpara no se enciende; lo mismo ocurre si se sumergen en una disolución de azúcar.
Por el contrario, si se sumergen en una disolución de Cloruro de Sodio NaCl o de Ácido Clorhídrico HCl, la lámpara brilla intensamente, lo que prueba que la disolución es un excelente conductor. Por otra parte, empleando Ácido Acético CH3COOH concentrado, la disolución conduce mal la corriente, pero cuando se diluye el Ácido con Agua H2O, su conductividad eléctrica aumenta.
Durante el paso de la corriente a través de distintas disoluciones, se obtienen diferentes productos en los electrodos.
En el curso de sus estudios sobre Electrólisis, Faraday dedujo las siguientes leyes:
1ª Ley: La cantidad de sustancia que tiene su transformación química en un electrodo es proporcional a la cantidad de electricidad que pasa a través de la disolución.
2ª Ley: Si se hace pasar una misma cantidad de electricidad a través de disoluciones diferentes, los pesos de las sustancias descompuestas o depositadas en los distintos electrodos son proporcionales a los pesos equivalentes de dichas sustancias.
Para citar un ejemplo:
Se supondrá que se tienen cinco cubas electrolíticas diferentes. La primera con Ácido Clorhídrico HCl, la segunda con Sulfato de Cobre CuSO4, la tercera con Cloruro Antimonioso SbCl3, la cuarta con Cloruro Estannoso SnCl2 y la quinta con Cloruro Estánnico SnCl4.
Se hace pasar la misma corriente a través de una serie de cubas electrolíticas, hasta que se hayan desprendido 1.008 gramos de Hidrógeno (un peso equivalente de Hidrógeno) de la disolución de Ácido Clorhídrico, los pesos (en gramos) de los otros productos liberados en igual tiempo son:
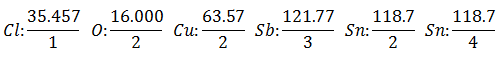
El Peso Equivalente tiene el valor del Peso Atómico del Elemento dividido por la Valencia del Elemento.
Para dejar en libertad un Peso equivalente de cualquier elemento se necesitan 96500 Coulombs. Esta cantidad de electricidad se denomina 1 Faraday.
La Unidad Faraday
El Ampere se define como una corriente uniforme que deposita 0.001118 gramos de plata (Ag) de una disolución de Nitrato de Plata (AgNO3) en un segundo. Como el peso Atómico de la Plata es 107.88 g/mol, la relación 107.88/0.001118 da el número de Ampere-segundos o Coulombs de electricidad requeridos para depositar un equivalente químico de Plata. Esta cantidad es de 96494 Coulombs (el valor 96500 es bastante aproximado para cálculos más sencillos), y se llama 1 Faraday de Electricidad.
Los Electrodos
Faraday llamó Ánodo al Electrodo Positivo, y Cátodo al Electrodo Negativo. También creó los términos Anión y Catión, aplicados a las sustancias que aparecen respectivamente en el ánodo y en el cátodo durante la Electrólisis.
Actualmente, otra definición que se tiene para los Electrodos es:
Ánodo: Electrodo en que hay pérdida de electrones u oxidación.
Cátodo: Electrodo en que hay ganancia de electrones o reducción.
Electrolitos y No Electrolitos
La conducción de la corriente eléctrica a través de las disoluciones no se explicó satisfactoriamente hasta 1887, en que Svante Arrhenius dio a conocer su teoría. Antes de apreciar y comprender la teoría de Arrhenius, se expone primero algunos de los hechos que la ciencia conocía cuando Arrhenius la formuló:
Las Soluciones de No Electrolitos tienen propiedades que pueden calcularse aplicando la ley de Raoult. Las presiones de vapor y los Puntos de Ebullición y de Congelación observados de dichas disoluciones son prácticamente iguales a los valores calculados.
La Ley de Raoult explica que la Presión de Vapor de cada Soluto en Disolución depende de su propia fracción molar en ella, multiplicada por su Presión de Vapor en estado puro.
![]()
La Ley de Raoult falla cuando se aplica a Soluciones de Electrolitos en Agua. Las variaciones de la presión de vapor y de los Puntos de Ebullición y de Congelación son siempre mayores que las predichas por la mencionada ley, y, además, aumentan al diluir.
Tales desviaciones se representan con el valor i, que es la relación de la Variación observada en el punto de congelación entre la variación calculada en el punto de congelación:
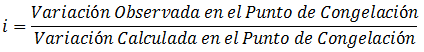
El valor de i es una medida de la desviación respecto a la Ley de Raoult, siendo igual a 1 cuando no hay desviación.
Conductividad eléctrica de los Electrolitos
Arrhenius investigó la conductividad de las disoluciones acuosas de electrolitos para averiguar cómo variaba dicha conductividad con la concentración de electrolito.
Midió la Conductividad Molar (que es la Conductividad correspondiente a un mol de Electrolito disuelto; esto es, la Conductividad especifica referida a un mol, y encontró que aumentaba con la dilución.
Arrhenius comparó sus resultados con medidas de las desviaciones de la Ley de Raoult, y encontró una estrecha relación entre éstas y la conductividad molar. En su teoría viene explicado el comportamiento de los electrolitos:
“Las Moléculas del Electrolito se disocian en partículas con carga eléctrica llamadas iones. La disolución es incompleta, y hay un equilibrio entre las moléculas y sus iones. Los iones conducen la corriente al moverse en el seno de la disolución”.
Las desviaciones de la Ley de Raoult se deben al aumento del número de partículas resultantes de la disociación parcial de las moléculas.
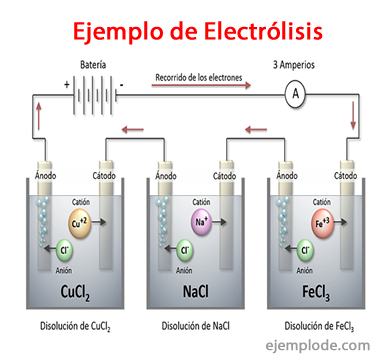
Ejemplos de Electrólisis
Algunas soluciones que se comportan como Electrolitos, es decir, tienen capacidad para Electrólisis son:
Cloruro de Sodio NaCl
Ácido Clorhídrico HCl
Sulfato de Sodio Na2SO4
Ácido Sulfúrico H2SO4
Hidróxido de Sodio NaOH
Hidróxido de Amonio NH4OH
Carbonato de Sodio Na2CO3
Bicarbonato de Sodio NaHCO3
Ácido Nítrico HNO3
Nitrato de Plata AgNO3
Sulfato de Zinc ZnSO4
¿Cómo citar? Figueroa, D. & Del Moral, M. (s.f.). Qué Es La Electrólisis.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4046-que_es_la_electrolisis.html

Últimos 10 comentarios