Ejemplo de Ósmosis
En Química, la Ósmosis es el fenómeno en que las concentraciones de dos soluciones se van equilibrando, gracias al paso del disolvente que las forma, a través de una membrana semipermeable que las mantiene separadas. Estas dos soluciones son en el principio de diferente concentración.
La Ósmosis ocurre en un sistema de tres elementos:
Dos soluciones liquidas, de las cuales una está más concentrada que la otra.
Una membrana semipermeable. Si fuera permeable, dejaría pasar la solución completa, con soluto y disolvente. Como es Semipermeable, sólo deja pasar el componente Disolvente. Esta característica se debe a su porosidad microscópica.
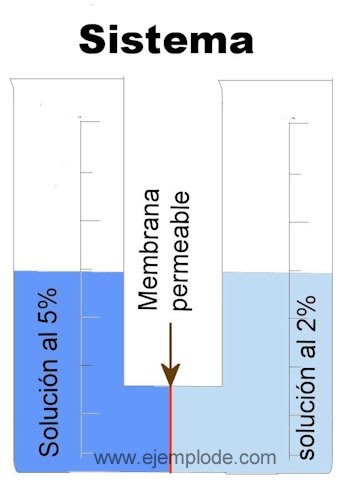
Las Soluciones están compuestas por dos sustancias: un Disolvente, que constituye la mayor parte, y que puede ser un gas o un líquido como el agua, y un Soluto, que es la sustancia disuelta.
Las soluciones del sistema de ósmosis pueden ser del mismo soluto o de sustancias diferentes, pero generalmente el Disolvente es el mismo.
El fenómeno de la ósmosis se da cuando dos soluciones están divididas por la membrana semipermeable, y solamente el disolvente pasa a través de la membrana para equilibrar la concentración de las soluciones.
El volumen de disolvente se desplazará hasta equilibrar la concentración de las soluciones en ambos lados del sistema. Es importante resaltar que lo que describe el avance de la Ósmosis no es el cambio de volumen del líquido, sino más bien la cambiante concentración que tienen las soluciones.
Por ejemplo, si en dos recipientes tenemos un litro de agua en cada uno, y en uno de ellos disolvemos 50 gramos de azúcar, mientras que en el otro sólo disolvemos 20 gramos, y luego estas soluciones las unimos con una membrana semipermeable, al cabo de cierto tiempo notaremos que parte del agua de la solución que contiene 20 gramos de azúcar, habrá pasado del lado donde habíamos disuelto 50 gramos.
Esto sucederá hasta que ambos lados del sistema tengan la misma concentración de soluto. La cantidad de soluto en cada lado (50 y 20 gramos respectivamente) no variará, solamente el agua traspasará la membrana.
Para determinar la cantidad de agua que pasa de un lado a otro, calculamos las concentraciones de solución:
Solución 1: 50g/1000 ml: solución al 5%
Solución 2: 20g/1000 ml: solución al 2%
Cada una de las soluciones se le denomina Fase. La que tiene una mayor concentración se le llama Hipertónica, y es la que absorberá líquido. La fase que tiene una concentración menor, se le llamará Hipotónica.
Cuando ambas fases están en equilibrio y por consiguiente tienen la misma concentración de soluto, se dice que son fases Isotónicas.
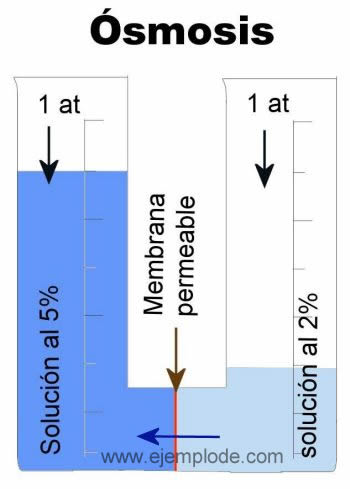
La variación ocurre hasta que ambos lados del sistema alcancen su punto de equilibrio. Así, al pasar el agua de la solución con menor concentración a la de mayor concentración, la cantidad de líquido variará entre una y otra, hasta que en los dos lados tenga la misma concentración, lo que será el punto de equilibrio:
Solución 1: 50 gramos en… | Solución 2: 20 gramos en… | ||
Mililitros: | Concentración: | Mililitros: | Concentración: |
1000 | 0,050 | 1000 | 0,020 |
1050 | 0,048 | 950 | 0,021 |
1100 | 0,045 | 900 | 0,022 |
1150 | 0,043 | 850 | 0,024 |
1200 | 0,042 | 800 | 0,025 |
1250 | 0,040 | 750 | 0,027 |
1300 | 0,038 | 700 | 0,029 |
1350 | 0,037 | 650 | 0,031 |
1400 | 0,036 | 600 | 0,033 |
1425 | 0,035 | 575 | 0,035 |
El cálculo de los datos de Concentración es sencillo. Los 50g y los 20g se van dividiendo, cada uno, entre el volumen que le va correspondiendo durante el cambio de la Ósmosis.
Esto sucede porque a través de la membrana sólo pasa el agua, y la cantidad de azúcar disuelta en ambos lados del sistema permanece idéntica. Sólo se van igualando las concentraciones de las soluciones.
Aunque en nuestro ejemplo hemos considerado en ambos componentes una solución de azúcar, esto sucede también con soluciones diferentes.
Contenido del artículo
Osmosis Inversa
La Ósmosis natural actúa como se ha explicado. Se caracteriza por que el sistema completo se encuentra a condición de Presión Atmosférica. El disolvente se desplazará libremente por la membrana semipermeable hasta generar el equilibrio.
El Proceso de la Ósmosis natural hace que la Solución diluida, es decir, con mucho disolvente, envíe disolvente a la concentrada, que tiene relativamente poco. Si el Proceso se quiere hacer rápido, se aplica una presión a la diluida para que se compensen las soluciones en menos tiempo.
Cuando se aplica presión a la otra solución, la Concentrada, se provoca un fenómeno llamado Ósmosis inversa. En la ósmosis inversa, la presión aplicada a la solución concentrada hace que casi quede el soluto seco, dejando del otro lado del sistema un disolvente abundante.
La ósmosis inversa es usada para purificar algunas soluciones. Uno de los usos más conocidos es la desalinización del agua de mar.
En un sistema a presión normal, al colocar agua de mar de un lado, y agua pura del otro, dado que el agua de mar es la fase hipertónica o concentrada, para equilibrar las concentraciones, absorberá agua. Al aplicar la ósmosis inversa, se aumentará la presión atmosférica en la fase hipertónica o concentrada, que para poder igualar la concentración de la fase hipotónica, debe ceder agua en lugar de absorberla. Sólo pasará el agua y la sal permanecerá en esta fase. Este sistema también se usa para purificar aguas residuales o contaminadas con bacterias, aunque resulta un procedimiento caro.

Ósmosis biológica
En las células también se lleva a cabo la ósmosis. La membrana celular separa el interior celular (que también es líquido) del medio circundante.
En las condiciones óptimas, las presiones son equilibradas, la célula está en sus condiciones normales de funcionamiento. Además del agua, la membrana celular permite también el paso de ciertas sustancias hacia el interior de la célula (nutrientes como la glucosa o los iones minerales) y la salida de los desechos celulares (metabolitos y toxinas).
Si el medio circundante se diluyera, la célula comenzaría a absorber agua para equilibrar las concentraciones de solución, lo que puede provocar que la célula explote. Por el contrario, si la solución circundante aumenta su concentración, la célula comenzará a sacar líquido, produciendo su deshidratación y dificultando sus funciones vitales. En el caso del ser humano y la mayoría de los animales, las concentraciones de solutos y el volumen de líquido, así como otras variables del medio líquido que rodea las células del cuerpo, son controladas por los riñones y el hígado.
Ejemplo de ósmosis:
En la vida diaria podemos encontrar ejemplos de ósmosis. Uno que podemos realizar con más facilidad consiste en partir una papa, en la que en uno de su extremos se coloca un poco de azúcar con agua. Mientras el otro extremo se coloca dentro un plato con agua. La papa es la membrana, el azúcar disuelto es la fase hipertónica y el agua en el plato es la fase hipotónica. Al cabo de algunas horas, podremos ver que en donde está la solución de azúcar, se ha entrado mayor cantidad de líquido.

Otras membranas osmóticas que podemos encontrar comúnmente son el cascarón del huevo, las zanahorias.
El principal uso de la Ósmosis inversa es la Purificación de Agua. En lugar de utilizar métodos químicos como la Cloración para desinfectar el agua, la membrana semipermeable tiene la capacidad de separar incluso las bacterias que provengan del agua residual tratada.
¿Cómo citar? Figueroa, D. & Figueroa,V. (s.f.). Ejemplo de Ósmosis.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4041-ejemplo_de_osmosis.html
