Ejemplo de Hidróxidos
Los hidróxidos son especies químicas conformadas por un metal o metaloide más un grupo Hidroxilo u Oxhidrilo (OH)-. Se caracterizan por poseer un carácter alcalino, o dicho de otro modo, por comportarse como Bases en solución acuosa. Por lo mismo reciben además el nombre de Álkalis. Es más sencillo catalogarlos como Bases de Arrhenius por su cualidad identificada de aportar los iones Hidroxilo a la solución. Se originan por dos principales mecanismos.
El primer mecanismo de síntesis de Hidróxidos consiste en el contacto de los metales alcalinos o alcalinotérreos puros con Agua. Se sabe que en el Agua existen de antemano los iones Hidrógeno (H+) e Hidroxilo (OH-), con sus cargas electrostáticas errantes en el medio acuoso. Al intervenir el metal, sus iones positivos, por ejemplo los del Sodio (Na+) interactúan con la carga que se encargue de recibir el electrón de su última capa. El otro producto de esta reacción generalmente es Hidrógeno gaseoso, en molécula diatómica.
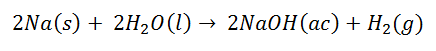
El segundo mecanismo de origen de los Hidróxidos consiste en la reacción de los Óxidos Básicos con el Agua. Los Óxidos básicos son los formados por los metales alcalinos, alcalinotérreos y los elementos Indio y Talio. Se caracterizan por generar como producto único el Hidróxido, ya que la presencia del Oxígeno del óxido permite la asociación con los iones hidrógeno que van quedando en el Agua.
Contenido del artículo
Hidróxidos Básicos y Anfóteros
La gran mayoría de los Hidróxidos tienen comportamiento básico, elevando el pH de las soluciones acuosas mediante la aportación de su grupo hidroxilo. Sin embargo, hay hidróxidos de determinados elementos que actúan como anfóteros, es decir, tanto con carácter ácido como con carácter básico. Estos son: Hidróxido de Berilio Be(OH)2, de Aluminio Al(OH)3, Estanoso Sn(OH)2, Plumboso Pb(OH)2, de Cromo III Cr(OH)3, Cúprico Cu(OH)2, de Zinc Zn(OH)2 y de Cadmio Cd(OH)2.
Por ejemplo, el Hidróxido de Aluminio Al(OH)3 reacciona tanto con ácidos como con bases:
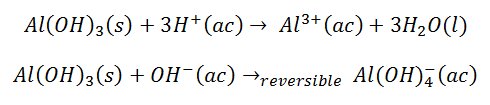
Todos los hidróxidos anfóteros son insolubles.
El Hidróxido de Berilio, al igual que el de Aluminio, es anfótero:
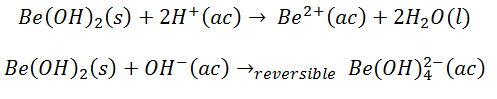
Ejemplos de Hidróxidos
Hidróxido de Sodio
El Hidróxido de Sodio, también conocido con el nombre de Sosa Cáustica, es un sólido blanco que se manifiesta en pequeñas lentejas; industrialmente se utiliza como disolución al 50% por su facilidad de manejo. Es soluble en agua de una manera exotérmica. Es higroscópico (absorbe humedad), absorbe dióxido de carbono CO2 del aire y es corrosivo de metales y tejidos.
Se emplea en síntesis, en el tratamiento químico de celulosa para fabricar rayón y celofán, en la elaboración de plásticos, jabones y otros productos de limpieza.
Se obtiene principalmente por electrólisis de cloruro de sodio NaCl; por reacción de hidróxido de Calcio Ca(OH)2 y Carbonato de Sodio Na2CO3 y al tratar sodio metálico con vapor de agua a bajas temperaturas.
El hidróxido de Sodio reacciona con metales como Aluminio, Zinc y Estaño, generando aniones como AlO2-, ZnO22- y SnO32- e Hidrógeno. Con los óxidos de estos metales, forma esos mismos aniones y Agua. Con Zn metálico hay ignición además. Con Bromo, y Cloroformo las reacciones son vigorosas o violentas. La reacción del NaOH con Tricloroetileno es peligrosa, ya que este último se descompone y genera Dicloroacetileno, producto inflamable.
Hidróxido de Potasio
También conocido como Potasa cáustica, se manifiesta como lentejas, al igual que el de Sodio. Se produce mediante la electrólisis de la salmuera de Cloruro de Potasio en celdas electrolíticas. Cuando la salmuera de Cloruro de Potasio es introducida en la celda electrolítica, el proceso resulta en una solución de hidróxido de Potasio y productos conjuntos de Cloro e Hidrógeno.
Se usa principalmente en la producción de Carbonato de Potasio, Fosfatos de Potasio, Fertilizantes líquidos y jabones y detergentes de potasio. Otros usos incluyen la galvanoplastia, herbicidas, grasa, catalizadores, oxidantes, medicamentos y pilas alcalinas-electrolíticas. El hidróxido de potasio se usa como intermedio director para varios productos químicos del potasio, que incluyen cianuro de potasio, aluminato, formato, fluosilicato, borohidruro, bromato, bromuro, gluconato, laurato, manganato, oleato y titanato.
Hidróxido de Calcio
El hidróxido de Calcio, llamado también Cal hidratada, es un polvo blanco generado por la hidratación del Óxido de Calcio CaO o Cal apagada. Es considerado una base fuerte, que genera un pH cercano a 13 en solución acuosa. Químicamente puro, combinado con Carboximetilcelulosa (CMC) forma un hidrogel.
Una de sus utilidades es que estimula la calcificación; activa los procesos reparativos por activación osteoblástica, al aumentar el pH en los tejidos. Es además antibacteriano; durante la elevación del pH la concentración de iones H+ disminuye y la actividad enzimática de las bacterias es inhibida. Puede esterilizar hasta un 88% de los conductos radiculares.
Se utiliza frecuentemente en la construcción, incorporándose a la mezcla del concreto. De Hidróxido de Calcio Ca(OH)2, se transforma en Óxido de Calcio CaO por la evaporación del agua con el calor solar. Después, en el contacto con el Dióxido de Carbono CO2 del aire, se transforma en Carbonato de Calcio CaCO3, que posee una dureza pétrea.
Hidróxido de Magnesio
El Hidróxido de Magnesio Mg(OH)2 es el componente principal de la Leche de Magnesia, agente químico para elevar el pH estomacal en caso de una extrema sensación de acidez. Es envasado en forma de tabletas o en solución líquida para tomar por vía oral. Además cuenta con efectos laxantes a corto plazo, por lo que es recomendado para el alivio temporal de la constipación.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Hidróxidos.Ejemplo de. Recuperado el 27 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4521-ejemplo_de_hidroxidos.html

Últimos 10 comentarios