Ejemplo de Hidrocarburos
Se llama Hidrocarburos al grupo de compuestos químicos orgánicos constituidos exclusivamente por Carbono e Hidrógeno. De acuerdo con su estructura, se pueden clasificar en Hidrocarburos Alifáticos e Hidrocarburos Cíclicos.
Contenido del artículo
Tipos de Hidrocarburos
Los tipos de hidrocarburos son dos y estos:
1. Hidrocarburos Alifáticos
Los Hidrocarburos Alifáticos se caracterizan por formar una cadena abierta de átomos de Carbono, con sus respectivos átomos de Hidrógeno. Por la naturaleza de los enlaces que contenga la cadena, los hidrocarburos se agrupan en series llamadas Series homólogas, en las que cada miembro se diferencia del siguiente por un grupo CH2.
Si los átomos de Carbono están siempre unidos por un enlace sencillo, se tienen los Hidrocarburos Alifáticos Saturados, o Alcanos o Parafinas. Son la primera Serie de la que se hablará.
Los compuestos en los que ya no existen exclusivamente enlaces sencillos, sino que se presentan enlaces dobles y/o triples, son llamados Insaturados.
Si entre dos átomos de Carbono hay un enlace doble, se tienen los Alquenos u Olefinas.
Si existe entre dos átomos de Carbono un enlace triple, se tendrán los Alquinos o Acetilenos. Última serie de los Hidrocarburos Alifáticos.
Alcanos o Parafinas
Pueden considerarse derivados del Metano (CH4), por sustitución de un H por un grupo Metilo (CH3-). Los miembros siguientes son el Etano (C2H6), el Propano (C3H8), el Butano (C4H10), el Pentano (C5H12), y los demás se nombran según el prefijo griego correspondiente al número de átomos de Carbono, seguido de la terminación ano. Por ejemplo: Hexano (C6H14), Heptano (C7H16), Octano (C8H18).
La variedad de cadenas normales o ramificadas aumenta con el número de carbonos incluidos. Se conoce la configuración de 2 butanos, 3 pentanos, 5 hexanos, 9 heptanos, 75 decanos C10H22, 355 dodecanos C12H26 y 1855 tetradecanos C14H30.
Para más información de los Alcanos, visita: Ejemplos de alcanos.
Alquenos u Olefinas
Los Alquenos u Olefinas contienen dos átomos de Hidrógeno menos que sus homólogos del mismo número de átomos de carbono de la serie de los alcanos, esto debido a que hay un doble enlace en ese lugar. Esto significa que habrá más reactividad, pues la tensión en el enlace adicional es más débil que en uno establecido con otro átomo. Hay más tendencia a que se generen reacciones de adición mediante la ruptura de ese doble enlace.
Su fórmula general es CnH2n, lo que significa que por cada “n” átomos de Carbono, habrá “2n” átomos de Hidrógeno. El nombre de estos hidrocarburos deriva de su correspondiente saturado, sustituyendo la terminación “ano” por “eno” o “ileno”, e indicándose la posición del doble enlace en la cadena, tomando en cuenta el primer Carbono que lo conforma.
El miembro más sencillo de esta serie es el Eteno o Etileno, C2H4. Como se combina con el Cloro para formar un aceite, C2H4Cl2, todos los miembros de la Serie reciben el nombre de Olefinas, por formadores de aceites.
El etileno se obtiene tratando el Bromuro de Etilo con Potasa o Sosa Cáustica en Disolución Alcohólica.
CH3 - CH2 - Br (KOH alcohólica) → C2 H4 + KBr + H2 O
También puede obtenerse el etileno deshidratando el alcohol etílico mediante ácido sulfúrico concentrado, anhídrido fosfórico o haciendo pasar los vapores de alcohol sobre arcilla o alúmina calentada a 400°C.
CH3 - CH2-OH (H2 SO4 ) → C2 H4 + H2 O
El etileno es un gas incoloro, de olor agradable. Tiene propiedades notables. Una mezcla de etileno y oxígeno se emplea como anestésico, sin producir las náuseas del éter, ni irritar los pulmones, además de ser de acción rápida y permite que el paciente recobre mucho antes el conocimiento. Acelera la maduración de las frutas y los vegetales. Además, el etileno reduce el periodo de latencia por el que pasan los tubérculos antes de comenzar su crecimiento.
El reconocimiento del doble enlace en los Alquenos se basa en la acción oxidativa del permanganato potásico en medio alcalino que cambia su color violeta a Pardo. Se adiciona un grupo OH a cada átomo de carbono. También por la acción de una disolución diluida de bromo, que se decolora al adicionarse el halógeno al doble enlace.
Ejemplos de Alquenos u Olefinas:
Eteno: CH2 = CH2
Propeno: CH2 = CH - CH3
1 - Buteno: CH2 = CH - CH2 - CH3
2 - Buteno: CH3 - CH = CH - CH3
1,3 - Butadieno: CH2 = CH - CH = CH2
1 - Penteno: CH2 = CH - CH2 - CH2 - CH3
2 - Penteno: CH3 - CH = CH - CH2 - CH3
1,4 - Hexadieno: CH2 = CH - CH2 - CH = CH - CH3
Alquinos o Acetilenos
Estos hidrocarburos presentan un triple enlace en su molécula y por tanto tienen un carácter de mayor reactividad química, o mayor insaturación. Su fórmula general es CnH2n-2. Por cada “n” átomos de Carbono, habrá “2n-2” átomos de Hidrógeno. El nombre de cada miembro de esta serie deriva del correspondiente hidrocarburo saturado, cambiando la terminación “ano” por “ino”, e indicándose también por un número la posición del enlace triple. También se les puede nombrar como derivados del Acetileno.
El primer término es el Acetileno o Etino, C2H2, que se obtiene corrientemente por la acción del agua sobre el Carburo de Calcio:
CaC2 + 2H2 O → C2 H2 + Ca(OH)2
El acetileno es un gas incoloro y tóxico, que arde con llama muy luminosa, por cuyo motivo se emplea para iluminación. Es muy inestable y en estado líquido altamente explosivo, descomponiéndose en Carbono elemental e Hidrógeno. A pesar de todo, se maneja sin peligro disuelto en acetona a presión.
Ejemplos de Alquinos o Acetilenos
Acetileno: CH ≡ CH
Propino: CH ≡ C - CH3
1 Butino: CH ≡ C - CH2 - CH3
2 Butino: CH3 - C ≡ C - CH3
1 Pentino: CH ≡ C - CH2 - CH2 - CH3
2. Hidrocarburos Cíclicos
Los hidrocarburos cíclicos constituyen cadenas cerradas, comenzando por el miembro de tres carbonos. Se pueden representar simplemente con figuras geométricas, cuyos lados equivalen a los enlaces de la cadena.
Cicloparafinas
Si los átomos de Carbono están siempre unidos por un enlace sencillo, se tienen los Hidrocarburos Cíclicos Saturados o Cicloalcanos o Cicloparafinas. Su fórmula general para conocer la relación que hay entre átomos de Carbono e Hidrógeno es CnH2n, lo que significa que por cada “n” átomos de Carbono, hay “2n” átomos de Hidrógeno.
Tienen otros dos nombres, Compuestos Alicíclicos (por ser alifáticos y cíclicos) y Naftenos por encontrarse en el petróleo.
Pueden obtenerse por la Síntesis de Wurtz, tratando un derivado dihalogenado con Sodio:
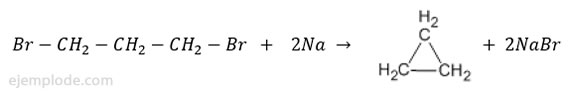
La formación de la cadena cerrada obliga a una modificación de la dirección de los enlaces. En un átomo de Carbono, dos enlaces forman normalmente un ángulo de casi 110°, mientras que en el Ciclopropano deben formar ángulos de 60°, determinando tensiones entre los enlaces y dando así lugar a un compuesto inestable. La tensión es nula para anillos de cinco átomos de carbono, siendo así el Ciclopentano C5H10, muy estable. La tensión es negativa para los anillos de mayor número de carbonos.
Ejemplos de Cicloparafinas
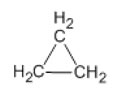 Ciclopropano
Ciclopropano
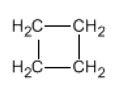 Ciclobutano
Ciclobutano
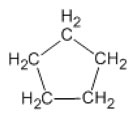
Ciclopentano
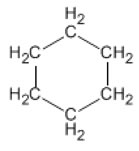 Ciclohexano
Ciclohexano
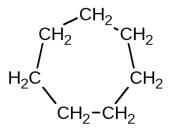
Cicloheptano
¿Cómo citar? & Del Moral, M. (s.f.). Ejemplo de Hidrocarburos.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4469-ejemplo_de_hidrocarburos.html
