Ejemplos de Enlace Metálico
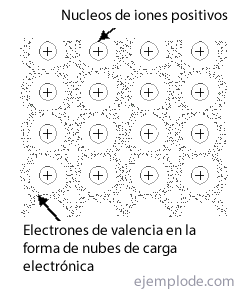
El Enlace Metálico es la manera en que los átomos de un metal logran reunirse en una estructura cristalina, estable, valiéndose de las nubes de sus electrones, y sin depender de la exclusividad de los enlaces iónicos o covalentes para manifestarse como sustancias puras. Se llama Red al grupo o disposición de enlaces metálicos.
La mayoría de los metales cristalizan en tres tipos de disposiciones: Redes Cúbicas de Cuerpo Centrado, Redes Cúbicas de Caras Centradas y Redes Hexagonales Compactas.
En la de cuerpo centrado, cada átomo del metal se rodea por 14 vecinos, y en las otras dos restantes por 12. Si se intenta abordar el enlace de tales estructuras, se va a encontrar inmediatamente el problema de la insuficiencia de electrones. Así, en el caso del Litio con un solo electrón de valencia y 14 vecinos próximos, se tiene que explicar cómo ese elemento está rodeado de tan grande número de átomos, y sin embargo, genera un cristal suficientemente estable para poseer un punto de fusión de 186°C. Lo mismo sucede con otros metales.
El físico suizo Felix Bloch en el año 1928 propuso una teoría mecánica cuántica para explicar el enlace de los átomos en los cristales metálicos. En esta Teoría de Bandas todos los electrones presentes en un átomo en niveles energéticos totalmente llenos se consideran esencialmente localizados, es decir, enlazados a los átomos a que se asocian. Por otro lado, los electrones de valencia en los niveles energéticos sin llenar se consideran libres, y se mueven en un campo potencial que se extiende a todos los átomos presentes en el cristal.
Los orbitales atómicos de estos electrones libres en un átomo pueden superponerse con los de otros para originar orbitales moleculares delocalizados que producen un enlace entre todos los átomos presentes, y que se conocen con el nombre de Orbitales de Conducción.
Los niveles energéticos de los electrones en átomos aislados son discretos y generalmente bien espaciados. Pero la presencia de otros átomos en el cristal afecta a estos niveles al transformar cada nivel en una banda de niveles cuyo número es igual al de los átomos presentes en la totalidad estructural. Si este número es grande, cada nivel aislado constituye prácticamente una banda continua. Además, cuando el espacio entre los niveles originales y entre los átomos en el metal es grande, entonces las bandas que se originan a partir de los niveles electrónicos primitivos se encuentran separados entre sí por lagunas de energía considerables. Cuando los niveles y las distancias son pequeñas, las bandas se cruzan y superponen entre sí.
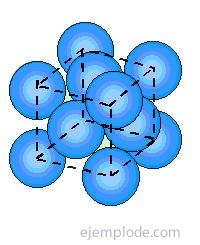
Esta teoría proporciona la siguiente descripción de la estructura electrónica de un metal dado. Un metal sólido se considera que posee bandas de electrones separadas entre sí por lagunas de energía. Además, dichas bandas están a veces totalmente llenas con electrones localizados, o lo están parcialmente con electrones libres cuyos orbitales moleculares se extienden a todos los átomos del cristal.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplos de Enlace Metálico.Ejemplo de. Recuperado el 13 de Junio de 2024 de https://www.ejemplode.com/38-quimica/4520-ejemplo_de_enlace_metalico.html
