Ejemplo de Enlace Iónico
El enlace iónico está dado por la presencia de un catión y un anión, especies químicas con cargas eléctricas de signos opuestos. Se define como la fuerza electrostática que une a los iones en un compuesto iónico.
Los átomos de los elementos con bajas energías de ionización tienden a formar cationes. En cambio, los que tienen alta afinidad electrónica tienden a formar aniones.
Los metales alcalinos y alcalinotérreos tienen más probabilidad de formar cationes en los compuestos iónicos, y los halógenos y el oxígeno son los más aptos para formar aniones. Como consecuencia, la composición de una gran variedad de compuestos iónicos resulta de la combinación de un metal del grupo IA o IIA y un halógeno u oxígeno.
Por ejemplo, la reacción entre Litio y Flúor produce Fluoruro de Litio, un polvo blanco venenoso que se usa para disminuir el punto de fusión de la soldadura y en la fabricación de cerámica. La configuración electrónica del Litio es 1s2, 2s1, y la del Flúor es 1s2, 2s2, 2p5. Cuando estos átomos entran en contacto, el electrón de valencia 2s1 del Litio se transfiere al átomo de Flúor.
![]()
Es válido asumir que el procedimiento comienza con el desprendimiento del electrón del Litio, ionizándose este para alcanzar la valencia positiva 1+. Continúa con la recepción de este electrón por parte del Flúor, lo que le confiere la carga negativa. Al final, ocurre por atracción electrostática la formación del enlace iónico. El compuesto Fluoruro de Litio será eléctricamente neutro.
Numerosas reacciones comunes llevan a la formación de enlaces iónicos. Por ejemplo, la combustión de calcio en oxígeno produce óxido de calcio:
![]()
La molécula diatómica de Oxígeno se separa en dos átomos individuales. Después habrá una transferencia de dos electrones del átomo de calcio a cada átomo de Oxígeno. Ambos tendrán entonces sus cargas respectivas: para el Calcio 2+ para cada átomo, y para el Oxígeno 2- para cada átomo. Al ocurrir la unión final, la molécula de Óxido de Calcio es eléctricamente neutra.
Contenido del artículo
Energía Reticular de los Compuestos Iónicos
Con los valores de energía de ionización y de afinidad electrónica de los elementos es posible predecir qué elementos forman compuestos iónicos, pero se requiere además evaluar la estabilidad de este tipo de compuestos.
La energía de ionización y la afinidad electrónica están definidas para procesos que ocurren en fase gaseosa, aunque todos los compuestos iónicos son sólidos a 1 atmósfera de presión y 25°C. El estado sólido es una condición muy distinta porque cada catión se rodea de un número específico de aniones y viceversa. En consecuencia, la estabilidad global del compuesto iónico sólido depende de las interacciones de todos los iones y no sólo de la interacción de un catión con un anión.
Una medida cuantitativa de la estabilidad de cualquier sólido iónico es su energía reticular, que se define como la Energía necesaria para separar completamente un mol de un compuesto iónico sólido en sus iones en estado gaseoso.
Ciclo de Born-Haber para determinar la Energía Reticular
No es posible medir la energía reticular directamente. Sin embargo, si se conoce la estructura y la composición de un compuesto iónico, es factible calcular su energía reticular aplicando la Ley de Coulomb, la cual establece que la energía potencial entre dos iones es directamente proporcional al producto de sus cargas e inversamente proporcional a la distancia que los separa.
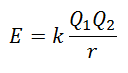
Dado que la carga del Catión es positiva y la del Anión es Negativa, el producto dará un resultado negativo en la Energía. Esto representa una reacción exotérmica. En consecuencia, para invertir el proceso se debe aportar energía.
También es viable determinar la energía reticular indirectamente si se supone que un compuesto iónico se forma en varias etapas. Este procedimiento se conoce como Ciclo de Born-Haber, el cual relaciona las energías reticulares de los compuestos iónicos con las energías de ionización, afinidad electrónica y otras propiedades atómicas y moleculares. Este método se basa en la Ley de Hess de Suma Algebraica de reacciones químicas, y fue desarrollado por Max Born y Fritz Haber. El ciclo de Born-Haber define las distintas etapas que preceden a la formación de un sólido iónico.

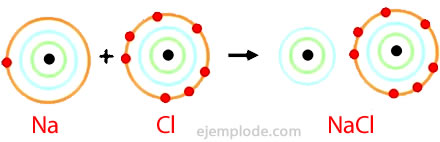
Cloruro de Sodio
El Cloruro de Sodio es un compuesto iónico con punto de fusión de 801°C, que conduce la electricidad en el estado fundido y en solución acuosa. La sal de roca es una de las fuentes de cloruro de sodio y se encuentra en depósitos subterráneos que suelen alcanzar varios cientos de metros de espesor. El cloruro de sodio se obtiene también de agua de mar o de la salmuera (una solución concentrada de NaCl) por evaporación solar. Además, se encuentra en la naturaleza en el mineral llamado Halita.

El cloruro de Sodio se utiliza más que cualquier otro material en la manufactura de compuestos químicos inorgánicos. El consumo mundial de esta sustancia es de unos 150 millones de toneladas anuales. El Cloruro de Sodio se utiliza sobre todo en la producción de otros compuestos químicos inorgánicos, como Cloro gaseoso, Hidróxido de Sodio, Sodio Metálico, Hidrógeno gaseoso y Carbonato de Sodio. También se emplea para fundir hielo y nieve en autopistas y caminos.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Enlace Iónico.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4499-ejemplo_de_enlace_ionico.html
