Ozono
El Ozono O3 es un compuesto de Oxigeno formado por tres átomos de éste. Tiene una molécula inestable que alterna un enlace entre Oxígenos, en un fenómeno llamado Resonancia. Forma parte de la Atmósfera, y su papel principal consiste en proteger el planeta de la alta incidencia de los rayos ultravioleta. Forma una delgada capa que evita que recibamos esa radiación con agresividad.
Contenido del artículo
¿Quién descubrió el ozono?
En 1785, M. van Marum percibió un olor singular cerca de máquinas eléctricas en funcionamiento. Cruikshank, en 1801, observó el mismo olor en Oxigeno recién preparado por electrólisis del Agua.
Schöbein, en 1840, fue el primero en reconocer que el olor obedecía a la formación de una sustancia distinta, a la que llamó Ozono, palabra que proviene del griego que significa “oler”. Encontró que se formaba en la proximidad de descargas eléctricas, durante la electrólisis del agua, y haciendo pasar aire húmedo sobre fósforo que se oxida lentamente.
Durante mucho tiempo, el ozono fue considerado un “peróxido” del hidrógeno, hasta que en 1863 Soret probó que sólo se componía de Oxigeno, y más tarde que la relación entre el Oxígeno y el Ozono era tal que Tres Volúmenes de Oxigeno producen Dos Volúmenes de Ozono.
Como el Ozono se obtiene directamente del Oxígeno O2, que se descompone formando Oxigeno monoatómico O y es una mitad más denso que el O2, es evidente que sus moléculas se componen de tres átomos de Oxigeno. Su fórmula es O3.
El Ozono O3 y el Oxigeno O2 son dos formas del mismo elemento. Pero sus moléculas respectivas poseen cantidades diferentes de energía química.
Estas formas diferentes de un elemento se llaman Formas Alotrópicas, y el fenómeno por el que aparece en más de una forma una sustancia elemental se denomina Alotropía.
Estado Natural del Ozono

Es frecuente la propaganda respecto a la presencia de ozono en el aire de algunas regiones, principalmente de sanatorios sitos en riberas o montañas. Tal pretensión suele basarse en ensayos que no distinguen el ozono de otras sustancias oxidantes, como el peróxido de hidrógeno, el cloro y óxidos de nitrógeno.
En realidad, es difícil aducir pruebas convincentes de la presencia de ozono en las capas bajas de la atmósfera, salvo de modo pasajero en la inmediata proximidad de una descarga eléctrica, como el rayo.
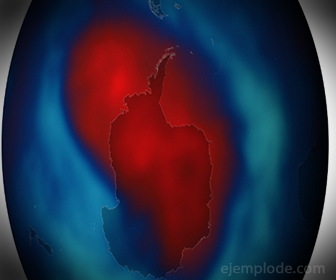
Existe Ozono en las capas atmosféricas superiores; la acción de la luz ultravioleta sobre el aire puede provocar la formación de Ozono en dichas regiones.
El aire absorbe la luz ultravioleta de manera que sólo una parte muy pequeña de ella llega a las capas bajas de la atmósfera. Las partículas de polvo, el calor y otros agentes destruyen el Ozono.
¿Cómo se obtiene el Ozono?
La conversión del Oxígeno en Ozono es una reacción Endotérmica, descrita con la ecuación:
Energia + 3O2 --> 2O3
En consecuencia, para preparar Ozono se necesitan grandes cantidades de energía; unas 32,400 calorías por cada 48gr (1mol) de Ozono formado.
Un foco de luz ultravioleta (lámpara de cuarzo con arco de mercurio) puede usarse como manantial energía.
Exponiendo Oxigeno a la luz Ultravioleta, se convierte parcialmente en Ozono. Si se quiere obtener una corriente continua de Oxigeno o de aire ionizado, se emplea la descarga eléctrica obscura o silenciosa.
Un sencillo aparato de esta clase consiste en dos tubos concéntricos de vidrio. La superficie interior del tubo interno se halla revestida de hoja de estaño, y conectada a uno de los polos de un carrete de inducción.
La superficie externa del tubo exterior está asimismo recubierta de hoja de estaño, y conectada al polo del carrete.
Se hace pasar lentamente por el espacio comprendido entre los tubos una corriente de Oxigeno o aire seco, sometiéndola así a la acción de la descarga silenciosa.
En una habitación oscura, esta descarga se hace visible en forma de luminiscencia azulada dentro del aparato. La concentración del Ozono en el Oxigeno Ozonizado de este modo es de un 5 a un 6%.
En algunos de los generadores comerciales de Ozono puede obtenerse un producto con una proporción de ozono hasta de un 17%.
Características y Propiedades del Ozono
El Ozono tiene una fórmula molecular O3, por lo que su Peso Molecular tiene un valor de 48 g/mol. Tiene su Punto de Ebullición a los -112°C. Su Densidad es de 2.142g/litro.
El Ozono es un gas azulado de olor picante característico. Es mucho más soluble en Agua que el Oxigeno; 50 volúmenes de Ozono se disuelven en 100 volúmenes de agua a 0°C, mientras que en el mismo volumen de agua y a temperatura y presión iguales sólo se disuelven cuatro volúmenes de Oxigeno.
El Ozono puede condensarse en un líquido azul haciéndolo pasar por un tubo en U sumergido en Oxígeno líquido a -182.5°C. Este líquido hierve a -112°C. Lo mismo como el Oxígeno, el Ozono líquido es Magnético.
El Ozono es relativamente inestable a la temperatura ordinaria, y se transforma poco a poco en Oxigeno. Como contiene más energía que el Oxígeno, se comporta como éste, pero más vigorosamente. Así, la mayoría de los compuestos orgánicos no reaccionan con el Oxígeno, y en cambio se “oxidan” rápidamente por el Ozono.
La goma, que se endurece gradualmente en el aire, lo hace con rapidez en Ozono. La plata metálica reacciona con ozono y forma Peróxido Argéntico, mientras que el Oxígeno puro no la modifica:
2Ag + 2O3 --> Ag2O2 + 2O2
El Oxígeno ejerce muy poco efecto sobre los compuestos que contienen iodo, pero el ozono libera iodo libre de ciertos cuerpos llamados ioduros, tal como el ioduro potásico, KI.
El iodo libre se reconoce fácilmente por su acción sobre el almidón, con el que se combina para formar una sustancia azul. Al ensayar la presencia de ozono por este medio, hay que tener presente que otras sustancias también dejan iodo libre del ioduro potásico.
Ejemplos de Aplicaciones del Ozono
- Transformar muchas sustancias orgánicas coloreadas, como colorantes vegetales y tintes, en compuestos incoloros.
- En la industria, para decolorar o blanquear aceites, ceras, harina y marfil, porque oxida los indicios de materias colorantes extrañas que contienen estos productos.
- Gracias a que destruye eficazmente los microorganismos, sirve para esterilizar el agua potable en algunas ciudades, y tiene la ventaja de no dejar más residuo que el Oxigeno.
- Para “sazonar” té, tabaco, cuero y madera.
- Como reactivo Oxidante en Reacciones REDOX.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ozono.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4870-ozono.html
