Bromo
El Bromo es un elemento químico, de Número Atómico 35, y que forma parte del Grupo VIIA, la Familia de los Halógenos. Se caracteriza por su facilidad para formar sales binarias con los metales alcalinos y alcalino-térreos.
Contenido del artículo
Historia del Bromo
Estudiando las aguas madres resultantes de la cristalización de sal de los pantanos de Montpellier, Francia, A. J. Balard obtuvo un líquido pardo oscuro muy irritante y de olor desagradable. Lo llamó “muride”, pero más adelante cambió el nombre por el de “bromo”, derivado del griego “bromos”, que significa mal olor. Balard demostró que la sustancia era un elemento afín al cloro y al iodo.
Estado Natural del Bromo
El Bromo se encuentra, en forma de Bromuro Sódico NaBr, Potásico KBr y Magnésico MgBr2. Aunque su concentración en el agua de mar no es mucha, también se extrae de ella comercialmente en cantidades considerables.

Obtención del Bromo
El Bromo puede prepararse por electrólisis de bromuros o por oxidación del Ácido Bromhídrico. El Cloro desaloja el Bromo de los bromuros.
![]()
Un buen método para preparar bromo en el laboratorio se basa en la acción del ácido sulfúrico concentrado sobre una mezcla de dióxido de manganeso y bromuro potásico:
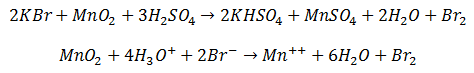
En ambos procesos, el ión Bromuro Br- pierde un electrón (se oxida) y deja Bromo libre, Br2.
La creciente demanda de gasolina “antidetonante” conteniendo Dibromuro de Etileno (C2H4Br2), y Plomo Tetraetilo Pb(C2H5)4 hizo insuficientes las reservas de Bromo, dirigiéndose la atención hacia el agua del mar como posible materia prima.
Propiedades Físicas del Bromo
El Bromo es un líquido denso de color pardorrojizo, que desprende vapores densos de olor muy irritante. Estos vapores abrasan la conjuntiva, y al respirarlos causan una grave inflamación en las vías respiratorias. En contacto con la piel produce serias quemaduras que tardan mucho en curar.
Su Peso Atómico es de 79.90 g/mol, y para su molécula diatómica, el Peso Molecular es de 159.80 g/mol. Su Densidad es de 3.119 g/ml. En estado sólido, se manifiesta como cristales rojos aciculares, y tiene su Punto de Fusión a los -7°C, y su Punto de Ebullición a los 59°C; ambos puntos indican que a temperatura ambiente el Bromo es líquido, y es sencillo volverlo gaseoso.
Es soluble en agua, y su disolución acuosa se llama “agua de bromo”. También es muy soluble este elemento en alcohol, éter, cloroformo, tetracloruro de carbono y sulfuro de carbono, con los que da disoluciones de color variable entre amarillo pajizo y pardorrojizo oscuro, según su concentración.

Propiedades Químicas del Bromo
Aunque menos activo, el Bromo se parece mucho al Cloro en su comportamiento químico. Se combina con el hidrógeno y los metales, con excepción del Platino y del Oro. No reacciona con el Carbono, Cloro, Nitrógeno u Oxígeno, pero se une con el Fósforo para formar Tribromuro y el Pentabromuro, y con el Azufre da Monobromuro S2Br2; forma compuestos con el Iodo y el Flúor.
Aplicaciones del Bromo
El Bromo se usa en la fabricación de drogas y colorantes. Algunos de sus compuestos como el Bromuro de Bencilo C6H5CH2Br, se emplean también como lacrimógenos por la policía y otros funcionarios de justicia.
Se utiliza para obtener Bromuro de Etileno destinado a combustibles para motores.
El Bromuro de Potasio se utiliza en medicina como sedante, y el Bromuro de Plata es una sustancia fundamental de la capa sensible de las placas, películas y papeles fotográficos.

Ejemplos de Compuestos del Bromo
Bromuro de Sodio NaBr
Bromuro de Potasio KBr
Bromuro de Calcio CaBr2
Bromuro de Magnesio MgBr2
Bromuro de Bencilo C6H5CH2Br
Bromuro de Plata AgBr
MonoBromuro de Azufre S2Br2
Bromuro de Hidrógeno HBr
Bromuro de Etileno C2H4Br2
Tribromuro de Fosforo PBr3
Pentabromuro de Fosforo PBr5
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Bromo.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4796-bromo.html
