Ejemplo de Bases Quimicas
En Química General, las Bases son una categoría de sustancias químicas que cumplen varias funciones:
-Reaccionar con los Ácidos en una Neutralización, produciendo una Sal y Agua.
-Regular el potencial de Hidrógeno, pH, elevando su valor, si se vierten en el medio donde se encuentre una reacción.
-Funcionar como Reactivos Químicos para un gran número de reacciones.
Las Bases pueden ser diferentes especies, tanto de la Química inorgánica como de la Química Orgánica, como los Hidróxidos, las Aminas y los Alcoholes, por ejemplo.
Para definir el comportamiento de las Bases, se utilizan las tres principales Teorías Ácido-Base: La de Arrhenius, la de Brönsted-Lowry y la de Lewis.
Contenido del artículo
Las Bases según Arrhenius
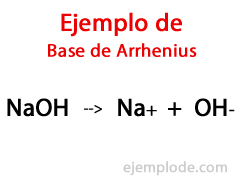
Según el Químico sueco Svante Arrhenius, las Bases son aquellas sustancias químicas que aportan iones hidroxilo (OH-) a un medio reaccionante, sobre todo si se trata de una solución acuosa. De este modo, con los iones hidroxilo disponibles, habrá un pH alcalino, es decir, con un valor mayor a 7, y hasta 14 dependiendo de cuánta Base esté presente a la hora de medirlo.
Esta es una de las Teorías más sencillas y prácticas para aplicar, ya que no tiene complicación para diferenciar las sustancias que intervienen en la reacción. Se sabe bien cuál es el Ácido y cuál es la Base.
Dentro de esta Teoría, quedan indiscutiblemente los Hidróxidos inorgánicos, como el Hidróxido de Sodio (NaOH) y el Hidróxido de Potasio (KOH).
Las Bases según Brönsted-Lowry
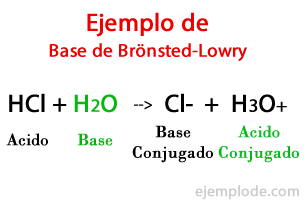
De acuerdo con la Teoría formulada por el danés Johannes Brönsted y el británico Thomas Martin Lowry, una Base es una especie Química capaz de recibir los Protones que otra, el Ácido, va a cederle durante una reacción química. Generalmente se relaciona el protón con la carga positiva que le caracteriza, por lo que lo podemos asociar de nuevo con los iones Hidrógeno (H+).
Cuando ocurre el intercambio en la reacción química, los productos son llamados: “Base conjugada del Ácido”, y “Ácido Conjugado de la Base”, basándose en los reactivos que los formaron.
Para esta Teoría, el Amoniaco (NH3) es el caso más representativo. Para Brönsted y Lowry, son Bases las sustancias que son capaces de Retener iones Hidrógeno (H+). En este caso, el Amoniaco, al comportarse como Base, va a adquirir un Hidrógeno en su estructura, consolidándose como un ión Amonio (NH4+), con la carga positiva sobrante del Hidrógeno. El Amonio es el Ácido Conjugado del Amoniaco.
Las Aminas, compuestos orgánicos derivados del Amoniaco (NH3), como la MetilAmina (CH3NH2), cuando se encuentran en solución se comportan como Bases, y son capaces de recibir en su estructura cargas positivas, ya sea de Hidrógenos, o de Carbocationes.
Un Carbocatión es un ión orgánico formado como una cadena de hidrocarburo, que a falta de un ión negativo, que puede ser el Hidroxilo (OH-) o un Halógeno (Cl-, Br-), tiende a unirse a un sitio que pueda recibirlo, que será la Base.
Las Bases según Lewis
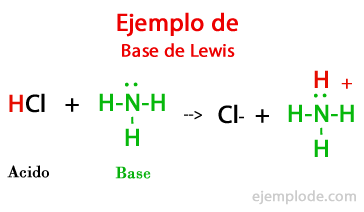
El científico estadounidense Gilbert Lewis señaló en su Teoría Ácido-Base que las Bases son aquellas sustancias que son capaces de aportar sus pares de electrones libres para que otra complete su octeto.
Esta Teoría Ácido-Base es un complemento para reafirmar la validez de su Regla del Octeto, en la que describe cómo los átomos adquieren la estabilidad alcanzando un número de ocho electrones en su última capa, usando el Enlace Covalente.
El ión Hidroxilo es un buen ejemplo de Base de Lewis. Tiene un par de electrones libres sobre los que podrá llegar un ión Hidrógeno que no tiene electrones. Se formará una molécula de Agua. Así se conformará el octeto para el Oxigeno de la molécula, y los Hidrógenos, que son átomos más pequeños, tendrán su par de electrones que los hará estables.
Usos de Bases importantes
El Hidróxido de Sodio NaOH se utiliza generalmente en solución acuosa para limpiar la grasa solidificada en las estufas domésticas e industriales, disolviéndola de manera efectiva. También se utiliza, en solución concentrada, cuando ocurren derrames imprevistos de una sustancia ácida, para Neutralizarla.
El Hidróxido de Magnesio Mg(OH)2 se utiliza en solución llamada “Leche de Magnesia”, para solucionar la acidez estomacal, neutralizándola. Se vende en farmacias.
El Hidróxido de Potasio KOH se utiliza como reactivo para los procesos de Saponificación, transformando las grasas en Jabón.
El Amoniaco NH3 se utiliza en su forma gaseosa como refrigerante industrial, sobre todo en las productoras de hielo. Es muy peligroso de utilizar, ya que respirar una concentración de 5 miligramos por litro de éste en el aire puede ser mortal.
Ejemplos de Bases Químicas
Agua H2O
Amoniaco NH3
Hidróxido de Sodio NaOH
Hidróxido de Potasio KOH
Hidróxido de Magnesio Mg(OH)2
Hidróxido de Calcio Ca(OH)2
Hidróxido de Aluminio Al(OH)3
Hidróxio de Amonio NH4OH
Hidróxido Ferroso Fe(OH)2
Hidróxido Férrico Fe(OH)3
Ión Hidroxilo (OH-)
Ión Cloruro (Cl-)
Ión Bromuro (Br-)
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Bases Quimicas.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4760-ejemplo_de_bases_quimicas.html

Últimos 10 comentarios