Ejemplos de Hidruros
Los Hidruros son los compuestos químicos formados por el elemento Hidrógeno y otro elemento, que puede ser un metal o un no metal.
Para comprender mejor los Hidruros, se dará una introducción acerca del Hidrógeno, el elemento central de estos compuestos.
Contenido del artículo
El elemento Hidrógeno
En el siglo XVI se observó que al actuar el Ácido Sulfúrico sobre el hierro se desprendía un gas combustible, y fue en 1766 que Sir Henry Cavendish probó que el gas era una substancia distinta, diferente de otros gases combustibles, si bien se confundió al considerar al gas, que él llamó “aire inflamable”, como procedente del metal y no del ácido.
También fue el mismo Cavendish quien, en 1781, demostró que se producía agua al combinarse el gas con el Oxígeno. Este último descubrimiento llevó a Lavoisier a llamarlo Hidrógeno, que significa “Productor de Agua”.
Características del Hidrógeno
El Hidrógeno no se encuentra abundantemente en estado libre sobre la tierra; los gases volcánicos y otros gases naturales lo contienen en escasa proporción, y también se encuentra en algunas rocas y en yacimientos de sales.
Ciertos metales como el Platino, el Paladio, el Tántalo, el Hierro, el Cobalto y el Níquel, tienen la propiedad de absorber Hidrógeno, por lo que éste se halla a veces asociado a ellos, como ocurre en algunos meteoritos.
La atmósfera contiene menos de una parte de Hidrógeno en un millón de partes de aire, aunque se cree que en las capas superficiales abunda más el Hidrógeno.
Se estima que casi la mitad de la masa del Sol es Hidrógeno, una cuarta parte Oxigeno, y el resto Helio y ciertos metales. En combinación, el Hidrógeno constituye una novena parte en peso del agua. Se encuentra en todos los ácidos, y es un constituyente importante del petróleo, de los gases combustibles naturales, y de los tejidos de todos los animales y plantas.
También forma parte esencial de nuestros alimentos y de muchas substancias químicas, como almidones, azúcares, alcoholes, glicerina, grasas, aceites, proteínas, ácidos e hidróxidos.
Los Hidruros
El Hidrógeno se combina más o menos intensamente con la mayoría de los elementos no metálicos y con algunos de los metales más activos. Estos compuestos binarios de Hidrógeno y otros elementos se llaman Hidruros. Hay dos tipos de Hidruros: Hidruros Metálicos, e Hidruros no Metálicos. El átomo de Hidrógeno del Hidruro es en realidad un ión Hidrógeno negativo, que ha sustraído al metal un electrón.
Hidruros Metálicos
Los compuestos que contienen metal e Hidrógeno se llaman Hidruros metálicos, tales como el Hidruro Sódico NaH, o el Cálcico CaH2.
Los Hidruros de los metales alcalinos y alcalinotérreos reaccionan fácilmente con el agua, para dar hidrógeno y el Hidróxido de los metales:
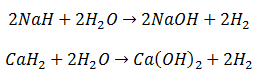
Hidruros No Metálicos
Los compuestos que contienen un no metal e Hidrógeno se llaman Hidruros No Metálicos, o también reciben nombres especiales que son más corrientemente usados, tales como el Cloruro de Hidrógeno (HCl), el Agua (H2O), el Amoniaco (NH3), la Fosfamina (PH3), el Sulfuro de Hidrógeno o Gas Sulfhídrico (H2S) y Metano (CH4).
Se explicarán a continuación algunos ejemplos de ambos tipos Hidruros:
Ejemplos de Hidruros
Ejemplos de Hidruros Metálicos
Hidruro de Litio (LiH): El Hidruro de Litio es un sólido cristalino incoloro, que es muy reactivo frente al Aire, el Agua y los Agentes Oxidantes. Es utilizado como Agente desecante, absorbiendo la humedad de sus alrededores. También como Refrigerante, como Generador de Hidrógeno y como ingrediente auxiliar en la fabricación de cerámicas.
![]()
Hidruro de Sodio (NaH): El Hidruro de Sodio, como el de Litio, demuestra tener propiedades desecantes, formando al final Hidróxido de Sodio. Además, resulta que es un buen reductor. Una reacción particular es la que tiene con el Tetracloruro de Silicio, liberando Silano (SiH4).
![]()
Hidruro de Potasio (KH): El Hidruro de Potasio también es capaz de reaccionar con el agua, para formar Hidróxido de Potasio (KOH), liberando Hidrógeno gaseoso. La reacción tiene tal poder que el Hidrógeno desprendido llega a arder, produciéndose una llama de color Lila en presencia de los iones de Potasio.
![]()
Hidruro de Berilio (BeH2): El Hidruro de Berilio, el primer elemento del grupo IIA, ya es insoluble, y se descompone en el Agua. Sus características principales son que no tiene enlaces iónicos, sino Covalentes, y que es un sólido blanco amorfo.
![]()
Hidruro de Calcio (CaH2): El Hidruro de Calcio es un compuesto formado por enlaces iónicos, y tiene una estructura cristalina. Es reactivo con el Agua, liberando gas Hidrógeno que puede encender instantáneamente.
![]()
Hidruro de Magnesio (MgH2): El Hidruro de Magnesio, al reaccionar con agua, forma Hidróxido de Magnesio Mg(OH)2, uno de los ingredientes principales de la Leche de Magnesia, que se utiliza para regular la acidez estomacal.
![]()
Hidruro de Fierro (FeH3): El Hidruro de Hierro III al reaccionar con el agua forma Hidróxido Férrico, que es un compuesto gelatinoso difícilmente soluble y filtrable. Esta característica es útil cuando se parte del Hidróxido Ferroso Fe(OH)2, que es soluble en las corrientes de las plantas electrolíticas, por lo que causa interferencia a la hora de querer electro depositar Zinc, por ejemplo. Se tiene la tarea de oxidar el Ferroso a Férrico.
![]()
Ejemplos de Hidruros No Metálicos
Agua (H2O): El Agua se encuentra presente en el planeta en una proporción inmensa, representando más de las tres cuartas partes de la masa de éste, ya incluyendo la que se encuentra como vapor en las nubes, como liquido en los océanos, y como hielo en los casquetes polares.
En la Química inorgánica, al Agua H2O se le considera el disolvente universal, al poder integrar físicamente consigo los compuestos minerales como las sales, los ácidos y los hidróxidos. También es capaz de retener algunos compuestos orgánicos, como los alcoholes, los éteres y los ácidos.
Amoniaco (NH3): El Amoniaco es un gas utilizado en la industria como agente refrigerante, o también como materia prima para el fertilizante Nitrato de Amonio: NH4NO3. El Amoniaco es muy peligroso porque si el ser humano lo llega a respirar a una concentración de entre el 16% y el 25%, se llegará a intoxicar. Además, a esa misma concentración, el Amoniaco se vuelve inflamable en el aire.
Borano (BH3): El Borano se utiliza como agente auxiliar para reacciones químicas en las que se producen alcoholes a partir de alquenos, con el mecanismo de Hidroboración-Oxidación.
Fosfamina (PH3): La Fosfamina o Fosfina es un gas incoloro e inflamable, que resulta explosivo a temperatura ambiente. Tiene un olor entre ajo y pescado podrido. Se sintetiza durante la degradación de la materia orgánica, y su principal aplicación es en el combate de plagas en granos almacenados en silos, donde hay un ambiente susceptible de tener presencia de humedad.
Cloruro de Hidrógeno (HCl): El Cloruro de Hidrógeno es un gas que se vuelve muy corrosivo al entrar en contacto con el agua, pues se activa su carácter ácido. Cuando llega a tocarse con la piel humana, se activa con la humedad que haya en ella, así que es muy peligroso. En una solución diluida, se utiliza junto con el Hipoclorito de Sodio para la limpieza de Sanitarios, con el nombre comercial de Ácido Muriático.
Sulfuro de Hidrógeno (H2S): El Sulfuro de Hidrógeno se genera en la putrefacción de la materia orgánica, es decir, en su degradación en ausencia de Oxigeno. Tiene olor a huevo podrido, porque efectivamente, se emite cuando se pudren los huevos.
Metano (CH4): El Metano es el más sencillo de los Hidrocarburos, que son los compuestos orgánicos constituidos solamente por Carbono e Hidrógeno; es utilizado como combustible en fines domésticos, porque su energía es bastante accesible. Los Hidrocarburos de moléculas más grandes son utilizados como combustibles en la industria, al ofrecer mayor poder calorífico.
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplos de Hidruros.Ejemplo de. Recuperado el 12 de Noviembre de 2025 de https://www.ejemplode.com/38-quimica/4687-ejemplo_de_hidruros.html
