Ejemplo de Gases Ideales Y Reales
Un Gas ideal es aquel cuyas propiedades como Presión, Temperatura y el Volumen que abarca, guardan siempre una proporción o relación constante entre ellas. En otras palabras, su comportamiento se apega a la Ley del Gas ideal, que se representa como sigue:
![]()
Para llegar a esta fórmula, se parte de La Ley General del Estado Gaseoso, que describe que hay una relación constante entre las propiedades del gas en todo momento de un proceso. Las propiedades de las que se habla son la Presión en el sistema donde está el gas, el Volumen que ocupa el gas, y la Temperatura del gas.
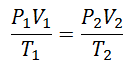
Se decidió tarde o temprano formar una expresión más sencilla, dando a la constancia una letra que acompañara a la expresión:
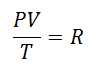
Se llamó Constante Universal de los Gases al factor R, y su valor es el siguiente:
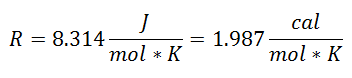
Y como la Constante Universal de los Gases aplica por cada mol del gas, se introdujo el Número de Moles del Gas como un factor más, para abarcar a toda la sustancia presente en el sistema durante el proceso. Ya se tendrá la ecuación final en esta forma:
![]()
La anterior ecuación es la Ley del Gas ideal, y aplica para gases que se encuentren a una temperatura entre moderada y alta. Así se podrá calcular cualquiera de las variables, teniendo las otras determinadas.
Contenido del artículo
Diferencia entre Gases ideales y Gases Reales
Esta Ley del Gas ideal no aplica para gases que se encuentren a temperaturas bajas o cercanas al punto en que se vuelven líquidos.
Las bajas temperaturas tienen como consecuencia un menor movimiento de las partículas del gas, y éstas se van a asentar más, ocupando un volumen diferente a cuando estuvieran completamente dispersas.
Además, por lo mismo, estarían ejerciendo una Presión desigual en todo el sistema. La proporcionalidad comenzará a fallar y la fórmula no tendrá la misma validez para los cálculos.
En ese caso, se deberán utilizar ecuaciones para gases Reales.
Un Gas Real es aquel cuyas propiedades no cumplen en relacionarse exactamente como en la Ley del Gas ideal, por lo que el modo de calcular dichas propiedades se modifica.
Ecuaciones de Estado para Gases Reales
1.- Ecuación Virial:
Para un gas que se mantenga a Temperatura Constante, la relación entre Presión y Volumen o Presión y volumen especifico (volumen ocupado por cada unidad de masa del gas).
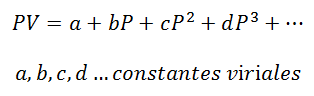
Las constantes viriales son características de cada gas, con valores específicos y que dependen de la Temperatura.
Sólo se pueden hacer cálculos de Presiones y Volúmenes; la Temperatura ya está previamente determinada observando el proceso. Para estos cálculos se despejan las variables de la ecuación virial:
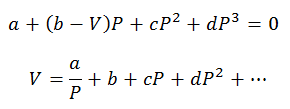
Las constantes viriales para resolver las ecuaciones se obtienen de tablas especializadas.
2.- Ecuación de Van der Waals:
La Ecuación de Van der Waals es otra expresión que sirve para calcular las propiedades de un Gas Real, y como la Ecuación Virial, también requiere sus constantes:

Las constantes también se consultan en tablas.
3.- Ecuación de Redlich-Kwong:
Esta ecuación sirve muy bien para hacer cálculos con gases a casi cualquier temperatura, y presiones medias, pero sin que sean demasiado elevadas, como de cientos de atmósferas.
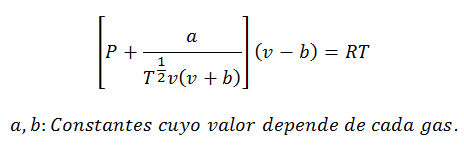
Las constantes también se consultan en tablas.
Se pueden despejar la Presión, la Temperatura y el Volumen, para hacer sus cálculos. Los despejes quedan:
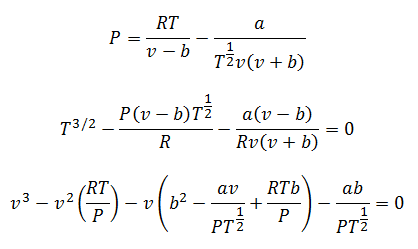
4.-Ecuación de Berthelot:
Es posible calcular cualquiera de las variables con esta ecuación. Sólo que tiene dos modalidades diferentes: Para bajas presiones y para altas presiones.
Para bajas presiones:

Para altas presiones:
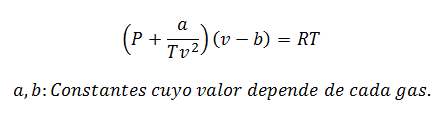
Las constantes también se consultan en tablas.
5.-Ecuación del Factor de Compresibilidad
Esta ecuación es una variante más sencilla de la Ley del Gas ideal; sólo se agrega el factor “z”, llamado Factor de Compresibilidad. Este factor se obtiene de la Gráfica de Factor de Compresibilidad Generalizado, dependiendo ya sea de la Temperatura, la Presión o el Volumen especifico, dependiendo de con qué se cuente.
![]()
Ejemplos de Gases ideales y reales
Como el carácter ideal o real depende de las condiciones de Presión, Temperatura en las que se encuentre el Gas, no es posible establecer una lista limitada, así que se presenta un listado de gases, que por supuesto se pueden encontrar en idealidad y realidad.
- Amoniaco
- Refrigerante R134 (DiFluoroDiCloro Etano)
- Dióxido de Carbono
- Monóxido de Carbono
- Oxigeno
- Nitrógeno
- Hidrógeno
- Dióxido de Nitrógeno
- Trióxido de Dinitrógeno
- Pentóxido de Dinitrógeno
- Heptóxido de Dinitrógeno
- Dióxido de Azufre
- Trióxido de Azufre
- Cloro
- Helio
- Neón
- Argón
- Kriptón
- Xenón
- Metano
- Etano
- Propano
- Butano
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Gases Ideales Y Reales.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/37-fisica/4672-ejemplo_de_gases_ideales_y_reales.html
