Ejemplo de Principio De AUFBAU
El principio de aufbau (composición) es un principio de la física atómica, que explica el acomodo de los electrones en sus órbitas alrededor del núcleo del átomo.
Los diversos estudios acerca de la naturaleza y configuración de átomo, que permitan entender sus características, ha sido materia de estudio de muchos investigadores. De entre ellos, destaca el trabajo de Niels Bohr, físico danés, que perfeccionó el modelo atómico propuesto por Ernest Rutherford.
Su modelo tiene las siguientes características: el núcleo del átomo ocupa el centro, mientras que el electrón gira alrededor en órbitas circulares. Para explicar el por qué no pierde energía en la órbita circular, y tomando en consideración los descubrimientos del comportamiento de onda y al mismo tiempo de partícula que tienen los electrones, consideró que los electrones saltan de nivel energético a otro, emitiendo o absorbiendo energía.
Sabía que estos niveles orbitales, se rigen por la ecuación 2n2, es decir, que el número máximo de electrones en una órbita es igual al doble del cuadrado del número de la órbita. Para los elementos conocidos hasta la fecha, tenemos 7 órbitas conocidas, en las cuales la órbita K tiene 2 electrones, la L, 8 electrones; la M tiene 18 electrones, la N contiene 32, la O contiene 50, la P contiene 72, y la Q contiene 98.
También se había descubierto que los electrones tienen cuatro números cuánticos: el principal n, que indica su distancia al núcleo; el número cuántico azimutal, l, que indica el orbital en que se encuentra (s, p, d, f, etc) un número cuántico magnético m, que determina su trayectoria dentro de un orbital, y un número de spin, de giro, s, que puede ser positivo o negativo, con valor de 1/2. Que dos electrones en la misma trayectoria, (mismos números n y l) no pueden tener al mismo tiempo el mismo número cuántico magnético o el mismo número de giro (spin). Es decir, que dos electrones de un átomo no pueden tener los cuatro números cuánticos iguales (principio de exclusión de Pauli)
Esto llevó a la conclusión de que para que puedan coexistir diferentes electrones en un mismo nivel orbital, , los niveles energéticos se dividen en subniveles, cada uno de los cuales se divide a su vez en orbitales que sólo pueden contener un par de electrones.
Conforme a esta observación, el nivel energético K, sólo contiene un subnivel, que se le llama nivel s, que puede ser ocupado por uno o por dos electrones.
El siguiente nivel, L, tendrá cuatro subniveles electrónicos: un nivel s, llamado 2s, y un nivel que se denomina 2p, que su vez está formado por tres orbitales, que se denominan 2px, 2py y 2pz. El tercer nivel tendrá los siguientes subniveles: 3s, 3p y 3d. El subnivel 3d, tendrá 5 orbitales, cada uno de los cuales estará ocupado por dos electrones. Los siguientes niveles pueden tener orbitales que se irán agregando, con las letras f, g, h e i.
A esto agregamos que cuando los electrones no son suficientes para completar un nivel energético, se reparten en los orbitales. (Regla de Hund).
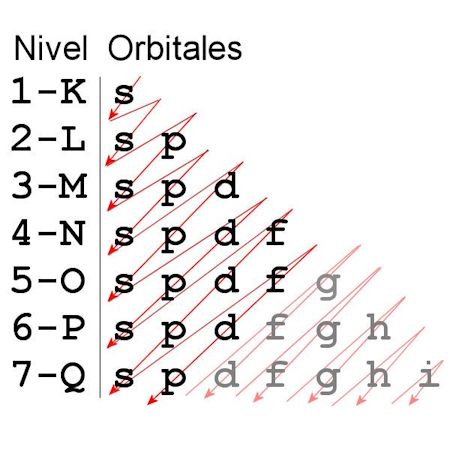
Estos subniveles y orbitales no se llenan al azar. Los electrones en las órbitas se organizan llenando primero los niveles con menor energía y después los de mayor energía. Esto se representa gráficamente, y por ello se le llama regla del serrucho o de las diagonales.
Conforme a las reglas anteriores, los niveles orbitales de los primeros 10 elementos de la tabla periódica, representados en la siguiente forma:
H: 1s1
He: 1s2
Li: 1s2 ,2s1
Be: 1s2 ,2s2
B: 1s2 ,2s2,2p1 (1s2 ,2s2,[2px1)
C: 1s2 ,2s2,2p2 (1s2 ,2s2,[2px1,2py1])
N: 1s2 ,2s2,2p3 (1s2 ,2s2,[2px1,2py1,2pz1])
O: 1s2 ,2s2,2p4 (1s2 ,2s2,[2px2,2py1,2pz1])
F: 1s2 ,2s2,2p5 (1s2 ,2s2,[2px2,2py2,2pz1])
Ne: 1s2 ,2s2,2p6 (1s2 ,2s2,[2px2,2py2,2pz2])
Como vemos en estos ejemplos, primero se llenan los niveles con menos energía, que en este caso son los niveles s, y luego el nivel p.
También podemos observar que la saturación de los niveles se da con los gases inertes Helio y Neón.
En muchas tablas periódicas encontramos como parte de los datos la estructura electrónica de los niveles energéticos, y para abreviar, encontramos entre paréntesis el elemento inerte previo al elemento, y luego el resto de los niveles orbitales.
Así por ejemplo, en el caso del sodio, podemos verlo representado de cualquiera de estas dos formas:
Na: 1s2 ,2s2,2p6,3s1
Na: [Ne],3s1
Ahora, si observamos la gráfica de los subniveles, veremos por ejemplo, que en elementos, como el Potasio o el calcio, a pesar de encontrarse en el nivel 4, no ocuparan el subnivel 3d, ya que este tiene mayor energía que el nivel 4s. Por lo que según la regla de Bohr, primero se ocupará el nivel 4s, antes que el 3d:
K: 1s2 ,2s2,2p6,3s2 ,3p6,4s1 – [Ar],4s1
Ca: 1s2 ,2s2,2p6,3s2 ,3p6,4s2 – [Ar],4s2
Sc: 1s2 ,2s2,2p6,3s2 ,3p6,4s1,3d1 – [Ar],4s1,3d1
Ti: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d2 – [Ar],4s2,3d2
La secuencia del orden de los orbitales según el principio de Aufbau y que podemos deducir observando las diagonales del gráfico, sería la siguiente:
1s2,2s2,2p6,3s2,3p6,4s2,3d10,4p6,5s2,4d10,5p6,6s2,4f14,5d10,6p6,7s2
Ejemplos del principio de Aufbau
Representación de los niveles electrónicos de algunos elementos según el principio de Aufbau:
Si: 1s2 ,2s2,2p6,3s2,3p2 – [Ne],3s2,3p2
P: 1s2 ,2s2,2p6,3s2,3p4 – [Ne],3s2,3p4
Ar: P: 1s2 ,2s2,2p6,3s2,3p6 – [Ne],3s2,3p6
V: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d3 – [Ar],4s2,3d3
Fe: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d6 – [Ar],4s2,3d6
Zn: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10 – [Ar],4s2,3d10
Ga: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p1 – [Ar],4s2,3d10,4p1
Ge: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p2 – [Ar],4s2,3d10,4p2
Br: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p5 – [Ar],4s2,3d10,4p5
Kr: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6 – [Ar],4s2,3d10,4p6
Rb: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s1 – [Kr],5s1
Sr: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2 – [Kr],5s2
Y: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d1 – [Kr],5s2,4d1
Zr: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d2 – [Kr],5s2,4d2
Ag: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d9 – [Kr],5s2,4d9
Cd: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d10 – [Kr],5s2,4d10
I: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d9,5p5 – [Kr],5s2,4d9,5p5
Xe: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d10,5p6 – [Kr],5s2,4d10,5p6
Cs: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d9,5p6,6s1 – [Xe],6s1
Ba: 1s2 ,2s2,2p6,3s2 ,3p6,4s2,3d10,4p6,5s2,4d10,5p6,6s2 – [Xe],6s2
¿Cómo citar? Figueroa,V. & Del Moral, M. (s.f.). Ejemplo de Principio De AUFBAU.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/37-fisica/4302-ejemplo_de_principio_de_aufbau.html
