Ejemplo de Elementos Químicos
Un Elemento químico es una sustancia pura constituida por átomos de un mismo tipo, a su vez formados por un número de protones y neutrones en el núcleo, y una cantidad de electrones en sus orbitales. Algunos se encuentran en forma natural, otros formando las moléculas de un compuesto, y otros han sido creados a través de la ejecución de procedimientos de laboratorio. Todos los elementos químicos conforman la materia de todo el universo, y sostienen la existencia y el funcionamiento del cuerpo humano.
Cada elemento tiene características y comportamientos que le dan una distinción y lo vuelven único, pero a la vez presenta similitudes con un grupo de elementos en la manifestación que tienen en el universo. Por tal razón, existe la Tabla Periódica de los Elementos Químicos, que atiende estas similitudes para agrupar con coherencia a los elementos, y que sea más fácil estudiar sus propiedades.
Contenido del artículo
- • Número atómico de un Elemento
- • Símbolo de un Elemento
- • Grupos de Elementos Químicos:
- • Grupo IA: Elementos Alcalinos:
- • Grupo IIA: Elementos Alcalino-Térreos:
- • Grupo IIIA: Elementos Térreos:
- • Grupo IVA: Familia del Carbono:
- • Grupo VA: Familia del Nitrógeno:
- • Grupo VIA: Familia del Oxígeno:
- • Grupo VIIA: Halógenos:
- • Grupo VIIIA: Gases Nobles:
- • Grupos B: Metales de transición:
- • Tierras Raras: Lantánidos y Actínidos:
Número atómico de un Elemento
El Átomo lleva en el núcleo un número de protones, acompañados del mismo número de neutrones. A este número se le llama Número Atómico, representado como Z para fines académicos y en la Literatura. Para cada Elemento, este número va a ser único. No hay dos Elementos con el mismo número atómico. La Tabla Periódica también se enfoca en este criterio para ordenarlos.
Símbolo de un Elemento
En los tiempos de la Alquimia, que abarcan aproximadamente del año 400 al 1000 d.C., los Alquimistas registraban sus experimentos asignándole símbolos a los elementos. Se trataba de símbolos sencillos, hechos con figuras geométricas, para representar al elemento individual y las transformaciones estudiadas.
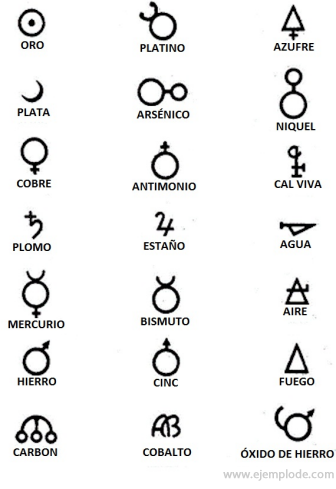
Algunos ejemplos de símbolos alquímicos, con el nombre del elemento o compuesto que representaban.
En la Era de la Química Moderna, los Elementos se siguen representando con símbolos, en este caso letras que hacen referencia a su nombre en latín o inglés.
Por ejemplo:
El símbolo del Sodio es Na, por su nombre en latín Natrium
El símbolo del Oro es Au, por su nombre en latín Aurum
El símbolo de la Plata es Ag, por su nombre en latín Argentum
El símbolo del Cobre es Cu, por su nombre en latín Cuprum
El símbolo del Antimonio es Sb, por su nombre en latín Stibium
El símbolo del Hierro es Fe, por su nombre en latín Ferrum
El símbolo del Mercurio es Hg, por su nombre en latín Hydrargyrum, que significa “Plata líquida”
El símbolo del Potasio es K, por su nombre en latín Kalium
Grupos de Elementos Químicos:
La Tabla Periódica de los Elementos Químicos clasifica estos por grupos: los grupos A y los grupos B. Los grupos A son ocho, que contienen los Elementos Alcalinos, los Alcalino-Térreos, los Térreos, tres familias de Elementos, cuya cabeza define el nombre de la familia: Familia del Carbono, Familia del Nitrógeno, Familia del Azufre, los Halógenos y los Gases Nobles. Los Grupos B están constituidos por todos los Metales de transición y las Tierras Raras, que también son dos grandes Familias: Lantánidos y Actínidos.
Grupo IA: Elementos Alcalinos:
La serie de elementos alcalinos está conformada por Hidrógeno (H), Litio (Li), Sodio (Na), Potasio (K), Rubidio (Rb), Cesio (Cs) y Francio (Fr). Todos tienen una configuración electrónica tal que en la última capa tienen un electrón. Su nombre se debe a que al entrar en contacto con agua, reaccionan formando Álcalis o Hidróxidos. Es un comportamiento general entre estos elementos. Mientras más grande es el átomo del elemento, es más reactivo, ya que la fuerza con que el núcleo retiene al electrón de la última capa tiene cada vez menos alcance. Son capaces de formar Enlaces Iónicos con los Halógenos. Por ejemplo: El enlace iónico que tiene una presencia abundante, es el de Sodio-Cloro, formando Cloruro de Sodio NaCl.
Grupo IIA: Elementos Alcalino-Térreos:
Estos elementos son: Berilio (Be), Magnesio (Mg), Calcio (Ca), Estroncio (Sr), Bario (Ba) y Radio (Ra). No se encuentran libres en la naturaleza; en cambio, existen con relativa abundancia sus carbonatos y silicatos. Son de color blanco argentino y cristalinos. Se combinan fácilmente con el oxígeno si se exponen al aire. Esto se debe, en parte, a que tienen dos electrones en su última capa, concordando con la capacidad receptora del Oxígeno. El Bario es el elemento más activo del grupo, y junto al Calcio, son los que más aplicaciones industriales tienen del grupo.
Grupo IIIA: Elementos Térreos:
El grupo IIIA comprende los elementos Boro (B), Aluminio (Al), Galio (Ga), Indio (In) y Talio (Tl). El Boro es un elemento no metálico, el Aluminio es anfótero (anfiprótico), es decir, que es capaz de actuar como ácido y como base; y los otros tres son elementos metálicos. Cuentan con tres electrones en su última capa, generando una valencia de +3, aunque a veces el Galio actúa con valencia +1 y +2 en algunos de sus compuestos. El Boro es el único elemento de esta serie que forma Hidruros. El Boro y el Aluminio forman Carburos.
Grupo IVA: Familia del Carbono:
Los elementos representativos del grupo IVA son el Carbono (C), Silicio (Si), Germanio (Ge), Estaño (Sn) y Plomo (Pb). Los dos primeros son fundamentalmente no metálicos en sus características, pero el Germanio, Estaño y Plomo son metálicos, y tanto más cuanto mayor es su número atómico. Con excepción del Silicio, cada elemento presenta las valencias +4 y +2.
El Carbono y el Silicio forman compuestos en los que están unidos átomos de los elementos por pares de electrones compartidos. El Carbono es la esencia de los compuestos Orgánicos al asociarse con átomos de Hidrógeno, Oxígeno, Nitrógeno, Azufre, y en ocasiones Silicio.
El Silicio y el Germanio son utilizados para la manufactura de componentes electrónicos, al tener la propiedad de comportarse como semiconductores.
Grupo VA: Familia del Nitrógeno:
El Grupo VA comprende los elementos Nitrógeno (N), Fósforo (P), Arsénico (As), Antimonio (Sb) y Bismuto (Bi). Nitrógeno y Fósforo son no metálicos, Arsénico y Antimonio son metaloides, y el Bismuto es un metal. Estos elementos se caracterizan por formar Hidruros, de los cuales el menos tóxico es el Amoníaco NH3. El Nitrógeno forma el Ácido Nítrico HNO3, involucrado junto con el Ácido Clorhídrico en el Agua Regia, mezcla capaz de disolver metales preciosos como el Oro y la Plata.
El Nitrógeno también se involucra en dos grandes grupos de compuestos orgánicos llamados Aminas y Amidas, que se pueden considerar derivados del Amoníaco NH3, por sustitución de un Hidrógeno por una cadena de Hidrocarburo.
Grupo VIA: Familia del Oxígeno:
Constituido por los elementos Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te) y Polonio (Po). El Oxígeno es el más activo, y tiene la cualidad de formar fácilmente enlaces covalentes. En contacto con los metales en un ambiente alto en humedad, forma óxidos. Forma una molécula resonante llamada Ozono, que protege al planeta de la radiación Ultravioleta.
Grupo VIIA: Halógenos:
Su nombre significa “Formadores de Sales”. El grupo está constituido por los elementos Fluor (F), Cloro (Cl), Bromo (Br), Iodo (I) y Ástato (At). Tienen siete electrones en la última capa, lo que les permite ser receptores de un electrón. Esta cualidad los hace vincularse con los elementos del grupo IA, formando Sales binarias. El Fluor se caracteriza por tener la Electronegatividad más grande de toda la Tabla Periódica, con valor de 4.0, siendo su contraparte el Cesio, con electronegatividad de 0.7. Esta propiedad le permite tener fuerza para atraer a otros átomos y darse prioridad para formar un enlace con ellos.
Grupo VIIIA: Gases Nobles:
Llamado también Grupo de los Gases Inertes, está formado por los elementos Helio (He), Neón (Ne), Argón (Ar), Kriptón (Kr), Xenón (Xe) y Radón (Ra). Son los elementos que tienen toda su configuración electrónica completa, por lo que no son capaces de reaccionar en condiciones usuales. Se utilizan sobre todo para anuncios comerciales luminosos, emitiendo luz visible al incidir en ellos una corriente eléctrica.
Grupos B: Metales de transición:
En diez grupos de tres elementos cada uno, se agrupan los metales de transición. Entre ellos se incluyen los mejores conductores eléctricos: Plata (Ag), Cobre (Cu), Oro(Au); los mejores componentes estructurales para la construcción urbana e ingeniería; Hierro (Fe), Titanio (Ti), Aluminio (Al), Zirconio (Zr), Tungsteno (W); los mejores componentes de catalizadores: Níquel (Ni), Vanadio (V), Platino (Pt); y los principales ingredientes de recubrimientos: Cadmio (Cd), Cromo (Cr), Zinc (Zn). Suelen manejar valencias entre +1 y +3, pero elementos como el Cromo manejan las valencias +2, +3, +6.
Tierras Raras: Lantánidos y Actínidos:
Se denominan Tierras Raras por su escasez en el planeta. Están formadas por dos grupos: Los Lantánidos y los Actínidos. Se encuentran en los dos renglones separados de la Tabla Periódica. Trabajan con valencia de +3 generalmente, y tienden a formar hidróxidos. El elemento más importante entre ellos es el Cerio, que se utiliza en la preparación de aleaciones pirofóricas (Aleación Mischmetal, para piedras para encendedores), en manguitos de gas para iluminación y en la fabricación de vidrios especiales que absorben los rayos ultravioleta y las radiaciones caloríficas.
Forman parte de estos grupos los elementos radiactivos más potentes, como el Uranio (U) y el Plutonio (Pu), que dada su inestabilidad, liberan energía y se van desintegrando, perdiendo partículas Alfa (núcleos de Helio). Posteriormente llegan a convertirse en elementos menos inestables, de acuerdo con la serie radiactiva.
¿Cómo citar? Figueroa,V. & Del Moral, M. (s.f.). Ejemplo de Elementos Químicos.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4519-ejemplo_de_elementos_quimicos.html
