Masa Atómica
La masa atómica es otro de las medidas importantes de los átomos, e indica cuál es su peso atómico, es decir, el peso de los componentes de su núcleo.
La masa atómica se denomina con la letra mayúscula “A”. Es la suma de la cantidad de protones y de neutrones presentes en el núcleo.
Los átomos tienen tres partículas elementales: los electrones, que se encuentran en las órbitas, tienen cargas negativas y son los que sirven para enlazarse a otros átomos. Al estar ionizados o combinados, el número de electrones varía, por lo que no es tomado en cuenta para determinar características como el número atómico, y como su peso es muy pequeño (alrededor de 1/1836 del peso de un protón) por lo que su peso no se toma en consideración al momento de determinar la masa atómica.
Los protones se encuentran en el núcleo del átomo. Tienen carga positiva y en condiciones de neutralidad, existe la misma cantidad de protones y de electrones.
Los neutrones son partículas subatómicas que también se encuentran en el núcleo y tienen más o menos la misma masa que el protón.
Para determinar la masa atómica de un elemento, se suman la cantidad de protones con la cantidad de neutrones de un átomo.
En general, la masa atómica de un elemento podría considerarse un número entero, ya que en general todos los átomos de un mismo elemento deberían ser iguales. Sin embargo esto no sucede en la realidad, ya que de forma natural hay algunas variantes de los elementos, llamadas isótopos.
Los isótopos son átomos de un elemento, que contienen el mismo número de electrones y protones, pero que varía su número de neutrones.
Unidades de medida de la masa atómica:
Todos los elementos, a excepción del hidrógeno, contienen protones y neutrones en su núcleo. En el caso del hidrógeno, sus átomos más abundantes tienen un electrón y un protón. Su número atómico es 1 y su masa atómica también es 1. En forma natural existe un isótopo del hidrógeno es el deuterio, que contiene un electrón, un protón y un neutrón. Su número atómico será también de 1, pero su peso atómico sería de 2. Existe un segundo isótopo natural, el tritio, el cual está compuesto de un electrón, un protón y dos neutrones. Igualmente tendrá un número atómico de 1, con un peso atómico de 3. El hidrógeno (también llamado protio) constituye el 99.98 % del hidrógeno que se encuentra en la naturaleza; el deuterio constituye aproximadamente el 0.015% y el tritio el restante 0.005%. Al sumar los pesos de cada isótopo y relacionarlos con sus porcentajes se obtiene la masa atómica promedio. En el caso de hidrógeno, es de aproximadamente 1.004.
Para determinar un punto de referencia para determinar las masas atómicas de los elementos, la Unión Internacional de Química Pura y Aplicada (IUPAC) estableció como patrón el isótopo de carbono 12. Este isótopo, el más abundante de este elemento, contiene 6 protones y 6 neutrones, y comparativamente a su masa atómica, se miden las partículas de los demás elementos y se determina su masa atómica. El átomo de hidrógeno (protio) pesa 1/12 de un átomo de carbono. A esta medida se le denomina u.m.a. (Unidad de masa atómica).
Instrumentos de medición de la masa atómica:
El instrumento utilizado para medir la masa de los átomos es el espectrógrafo de masas. En esta máquina, el elemento a analizar es bombardeado con partículas subatómicas, con lo cual se ioniza; es atraído mediante un campo magnético hacia una pantalla en donde golpearán, variando el punto de impacto según el peso de cada átomo. Una vez medido esto, se determina el número de átomos y de isótopos, y se calcula la relación entre los átomos del elemento y la misma cantidad en átomos de carbono 12.
Nomenclatura de la masa atómica:
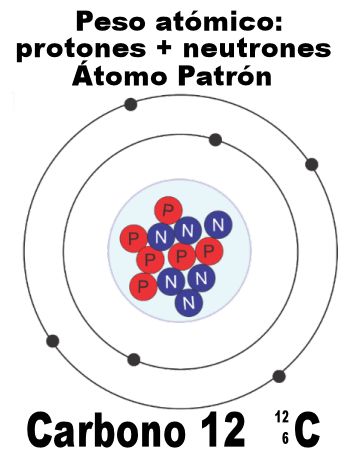
A excepción del hidrógeno, los isótopos de los elementos no tienen nombres especiales, por lo que al hablar de ellos, se menciona como parte de su nombre, su peso atómico. Así, en el caso del Uranio, podemos hablar del Uranio 234, Uranio 235 y Uranio 238, siendo éste último el más abundante y el que se considera cuando se habla solamente de Uranio.
Al representar los elementos, su peso atómico se escribe como un superíndice del lado izquierdo del símbolo químico. En las tablas periódicas lo encontramos en diversos sitios y generalmente es la masa atómica relativa, es decir, la medida en relación a una muestra tomada como referencia.
¿Cómo citar? Figueroa, D. & Del Moral, M. (s.f.). Masa Atómica.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4048-masa_atomica.html
